Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Dùng quỳ tím
+) Hóa xanh: NaOH
+) Không đổi màu: Các dd còn lại
- Đổ dd BaCl2 vào các dd còn lại
+) Xuất hiện kết tủa: Na2SO4
PT: \(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
+) Không hiện tượng: Các dd còn lại
- Đổ dd AgNO3 vào 4 dd còn lại
+) Kết tủa trắng: NaCl
PT: \(Ag^++Cl^-\rightarrow AgCl\downarrow\)
+) Kết tủa vàng nhạt: NaBr
PT: \(Ag^++Br^-\rightarrow AgBr\downarrow\)
+) Kết tủa vàng đậm: NaI
PT: \(Ag^++I^-\rightarrow AgI\downarrow\)
+) Không hiện tượng: NaNO3
Cho một ít AgNO3 vào từng chất, nếu:
+Kết tủa trắng: NaCl
\(AgNO_3+NaCl\rightarrow AgCl\downarrow+NaNO_3\)
+Kết tủa vàng nhạt: NaBr
\(AgNO_3+NaBr\rightarrow AgBr\downarrow+NaNO_3\)
+Kết tủa vàng đậm: NaI
\(AgNO_3+NaI\rightarrow AgI\downarrow+NaNO_3\)
+Chất bị phân hủy hoặc không tồn tại:NaOH
\(AgNO_3+NaOH\rightarrow AgOH+NaNO_3\)
+Chất không phản ứng: \(Na_2SO_4,NaNO_3\)
Cho một ít BaCl2 vào hai chất trên, nếu:
Kết tủa trắng: Na2SO4, còn lại là NaNO3.
\(Na_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2NaCl\)

- Cho các chất tác dụng với dd Ca(OH)2
+ Không hiện tượng: NaNO3
+ Có khí mùi khai: NH4NO3, NH4Cl (1)
2NH4NO3 + Ca(OH)2 --> Ca(NO3)2 + 2NH3 + 2H2O
2NH4Cl + Ca(OH)2 --> CaCl2 + 2NH3 + 2H2O
+ Kết tủa trắng: Na3PO4
2Na3PO4 + 3Ca(OH)2 --> 6NaOH + Ca3(PO4)2\(\downarrow\)
- Cho 2 dd ở (1) tác dụng với dd AgNO3
+ Không hiện tượng: NH4NO3
+ Kết tủa trắng: NH4Cl
NH4Cl + AgNO3 --> NH4NO3 + AgCl\(\downarrow\)

Dùng dung dịch A g N O 3 để phân biệt các muối: N a 3 P O 4 , NaCl, NaBr, N a 2 S , N a N O 3 .
Lấy mỗi muối một ít vào từng ống nghiệm, thêm nước vào mỗi ống và lắc cẩn thận để hoà tan hết muối. Nhỏ dung dịch A g N O 3 vào từng ống nghiệm.
- Ở dung dịch nào có kết tủa màu trắng không tan trong axit mạnh, thì đó là dung dịch NaCl :
NaCl + A g N O 3 → AgCl↓ + N a N O 3 (màu trắng)
- Ở dung dịch nào có kết tủa màu vàng nhạt không tan trong axit mạnh, thì đó là dung dịch NaBr :
NaBr + A g N O 3 → AgBr↓ + N a N O 3 (màu vàng nhạt)
- Ở dung dịch nào có kết tủa màu đen, thì đó là dung dịch Na2S :
N a 2 S + 2 A g N O 3 → A g 2 S ↓ + 2 N a N O 3 (màu đen)
- Ở dung dịch nào có kết tủa màu vàng tan trong axit mạnh, thì đó là dung dịch Na3PO4 :
N a 3 P O 4 + 3 A g N O 3 → N a 3 P O 4 + 3 N a N O 3 (màu vàng)
- Ở dung dịch không có hiện tượng gì là dung dịch N a N O 3 .

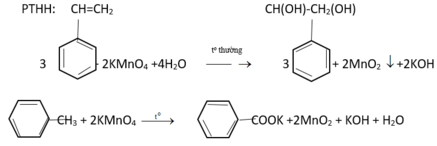
- Cho 3 chất lỏng tác dụng với dung dịch KMnO4 ở nhiệt độ thường, chất nào làm mất màu dung dịch KMnO4 ở nhiệt độ thường là stiren.
- Với 2 hỗn hợp phản ứng còn lại ta đem đun nóng, chất nào làm mất màu dung dịch KMnO4 (nóng) thì là toluen, còn lại là benzen.

Dãy chuyển hoá biểu diễn mối quan hệ giữa các chất có thể là :
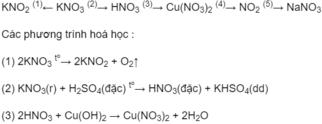

Câu 19: Cho các chất sau: Al(OH)3, HCl, KHCO3, NaCl, Na2SO4, H2SO4. Trong đó muối trung hoà gồm:A. Al(OH)3, HCl. B. NaCl, Na2SO4.C. KHCO3. D. HCl, H2SO4 Câu 20: Công thức hoá học của chất khi điện li tạo ra ion Mg2+ và Cl- làA. Mg(OH)2.B. MgCl2.C. KCl.D. MgSO4. Câu 21: Dung dịch làm quỳ tím hoá xanh làA. H3PO4.B. H2S.C. NaOH.D. HCl. Câu 22: Dung dịch H2S chứa tối đa những ion (bỏ qua sự điện li của nước):A. H+, HS-,S2-.B. HS-, S2-.C. H+, S2-.D. H+, HS-. Câu 23: Phương trình điện li nào sau đây đúng?A. CH3COOH→H+ + CH3COO-.B. HClO → H+ + ClO-.C. NaCl→ Na+ + Cl-.D. H3PO4→ H+ + H2PO42-. Câu 24: Cho 10ml dung dịch HNO3 có pH=4. Cần thêm bao nhiêu ml nước cất để thu được dung dịch có pH=6?A. 990 ml.B. 1000 ml.C. 100 ml.D. 400 ml. Câu 25: Chất nào sau đây là axit 2 nấc?A. HCl.B. Ba(OH)2.C. H2S.D. H3PO4. Câu 26: Một dung dịch chứa 0,01 mol Na+; 0,02 mol SO42-; 0,01 mol Cl- và x mol Cu2+. Giá trị của x làA. 0,04.B. 0,01.C. 0,02.D. 0,05. Câu 27: Cho các chất: NaCl, H2O, glucozơ (C6H12O6), KOH, Na2CO3, BaSO4, HF. Số chất điện li mạnh làA. 3.B. 5.C. 2.D. 4. Câu 28: Cho các cặp chất sau: (1)Na2CO3+Ba(OH)2(2) Fe + HCl (3) BaCl2 + Na2CO3(4)MgCO3+Ba(OH)2(5) CaCO3+H2SO4 Các phản ứng đều có cùng một phương trình ion rút gọn làA. (1),(2),(3),(4). B. (1),(3),(4),(5). C. (1),(3),(4). D. (1),(3).

a)
- dùng quỳ tím:
+NaOH --> xanh
+H2SO4, HCl --> đỏ
-dùng dd BaCl2:
+Tạo kết tủa trắng : H2SO4
+Ko pư: HCl

Tham khảo:
a) Trong 4 chất trên acetic acid có nhiệt độ sôi cao nhất. Do phân tử acetic acid chứa nhóm carbonyl phân cực, các phân tử carboxylic acid liên kết hydrogen với nhau tạo thành dạng dimer hoặc dạng liên phân tử.
b) Cách phân biệt: ethanol, propanal, acetone, acetic acid:
- Trích mẫu thử.
- Cho vào mỗi mẫu thử 1 mẩu quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → acetic acid (CH3COOH).
+ Quỳ tím không đổi màu → ethanol, propanal, acetone (nhóm I).
- Cho từng mẫu thử ở nhóm I tác dụng với Na:
+ Mẩu Na tan dần, có khí thoát ra → ethanol (C2H5OH).
Phương trình hoá học: 2C2H5OH + 2Na → 2C2H5ONa + H2.
+ Không hiện tượng → propanal, acetone (nhóm II).
- Cho từng mẫu thử ở nhóm II tác dụng với dung dịch bromine:
+ Dung dịch bromine nhạt dần đến mất màu → propanal.
Phương trình hoá học:
CH3 – CH2 – CHO + Br2 + H2O → CH3 – CH2 – COOH + 2HBr.
+ Không hiện tượng → acetone.

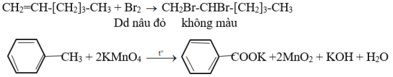
– Cho các chất lần lượt tác dụng với dung dịch Br2, chất nào làm nhạt màu dung dịch Br2 thì đó là hex-1-en.
- Cho 2 chất còn lại qua dung dịch KMnO4, chất nào làm mất màu dung dịch KMnO4 thì đó là toluen.
PTHH:
* Đưa giấy quỳ vào các chất. NaOH hoá xanh.
- NaCl, NaNO3 không đổi màu (nhóm 1).
- HNO3, HCl, H2SO4 hoá đỏ (nhóm 2).
* Nhỏ AgNO3 vào 2 chất nhóm 1.
- NaCl có kết tủa trắng.
- NaNO3 không hiện tượng.
PTHH: AgNO3+NaCl→AgCl+NaNO3
* Nhỏ BaCl2 vào 3 chất nhóm 2.
- H2SO4 có kết tủa trắng.
PTHH: BaCl2+H2SO4→BaSO4+2HCl
* Nhỏ AgNO3 vào 2 chất còn lại.
- HCl kết tủa trắng.
- Còn lại là HNO3.
PTHH: AgNO3+HCl→AgCl+HNO3