Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đường kính dần dần hoá thành chất rắn màu đen, sau đó trong cốc sủi bọt đẩy chất rắn màu đen trào ra ngoài cốc.

Bạn tham khảo câu trả lời của mình nha :
Ống (1) CH3 – CH2Br + H2O → CH3- CH2OH + HBr
AgNO3 + HBr → AgBr + HNO3
Ống (2) không có phản ứng, chứng tỏ liên kết C- Br trong phản ứng brombenzen rất bền

Hiện tượng: Xuất hiện kết tủa trắng.
1) Phương trình hoá học dạng phân tử:
\(Na_2SO_4+BaCl_2\rightarrow BaSO_4+2NaCl.\)
Phương trình hoá học dạng ion thu gọn:
2) Dự đoán hiện tượng khi nhỏ dung dịch BaCl2 vào ống nghiệm đựng dung dịch \(H_2SO_4\) oãng là xuất hiện kết tủa trắng barium sulfate theo phương trình hoá học:
\(H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl.\)
1: PTHH: \(H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\)
PT Ion: \(SO_4^{2-}+Ba^{2+}\rightarrow BaSO_4\downarrow\)
2: Hiện tượng: Xuất hiện kết tủa trắng

1:
\(Cu+2H_2SO_4\left(đặc\right)\rightarrow CuSO_4+SO_2+2H_2O\)
Chất oxi hóa: H2SO4
Chất khử: Cu
2: Dung dịch H2SO4 đặc có tính oxi hóa mạnh, có thể oxi hóa kim loại hoạt động kém như đồng

1. Khí sinh ra do Cu + HNO3 đặc, nóng là khí NO2 (màu nâu đỏ). Cho vào ống nghiệm 1 để ngoài không khí có màu nâu đỏ. Ống nghiệm 2 để trong thùng nước đá màu nâu đỏ nhạt hơn do khi lạnh NO2 (màu nâu đỏ) chuyển hóa một phần thành N2O4 (không màu). \(PTPƯ:Cu+4HNO_3\rightarrow Cu\left(NO_3\right)_2+2NO_2+2H_2O\)
\(2NO_2\underrightarrow{^{to-thap}}N_2O_4\)
2. Hiện tượng: Phía bên cốc đựng dd NaOH sẽ nghiêng xuống làm cho cân mất thăng bằng.
Giải thích: Trong không khí luôn có một lượng nhỏ khí CO2. Dd NaOH hấp thụ khí CO2 do xảy ra
\(PTPU:2NaOH+CO_2Na_2CO_3+H_2O\)
Lượng CO2 hấp thụ thêm vào dd NaOH làm cho khối lượng cốc đựng dd NaOH tăng lên.

1: Kết tủa đó là chất Cu(OH)2
2: \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
\(CH_3CHO+2Cu\left(OH\right)_2\rightarrow CH_3COONa+Cu_2O+3H_2O\)
1. Kết tủa Cu(OH)2
2.
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow\left(xanh.lam\right)+Na_2SO_4\\ 2Cu\left(OH\right)_2+CH_3CHO+NaOH\rightarrow CH_3COONa+Cu_2O\downarrow\left(đỏ.gạch\right)+3H_2O\)

tham khảo.
Hiện tượng: Khi đun nóng dung dịch muối ammonium với NaOH đặc, xuất hiện khí có mùi khai, xốc. Đặt mẩu quỳ tím ẩm lên miệng ống nghiệm, quỳ tím hóa xanh.
Giải thích: Khi đun nóng dung dịch muối ammonium với NaOH đặc, sinh ra khí ammonia có mùi khai, xốc. Khí ammonia tiếp xúc với nước trong quỳ tím ẩm, ammonia nhận H+ của nước, tạo thành ion ammonium (), dung dịch có tính base yếu, làm giấy quỳ tím hóa xanh.
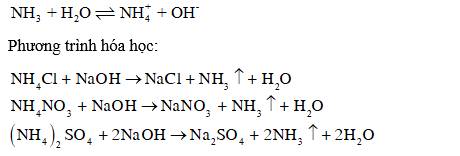
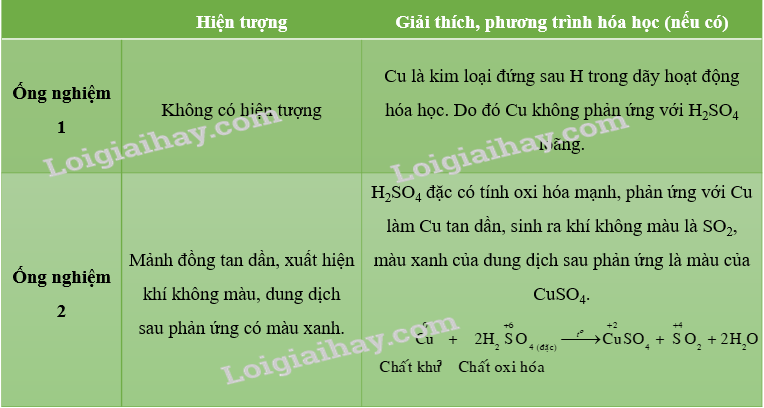

Hiện tượng: Cu tan, tạo thành dung dịch có màu xanh làm, có bọt khí thoát ra