Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nCaCO3=10 :100 = 0,1 (mol)
pthh : CO2 + Ca(OH)2 ---> CaCO3 + H2O
0,1<-------------------0,1 (mol)
=> V = VH2 = 0,1.22,4=2,24 (l)

Coi như hỗn hợp X chỉ gồm Na, K, Ba, O
Cho X vào nước thì 3 kim loại phản ứng sinh ra khí H2, còn O tác dụng với H2 để tạo ra nước theo tỷ lệ 1Oxi+1H2
\(\Rightarrow\) \(n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_O=0,14\left(mol\right)\)
Có \(n_{Na}=n_{NaOH}=0,18\left(mol\right)\)
\(n_K=n_{KOH}=\frac{0,044m}{56};n_{Ba}=n_{Ba\left(OH\right)_2}=\frac{0,93m}{171}\left(mol\right)\)
\(\Rightarrow n_O=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_{H_2}=0,09+\frac{0,022m}{56}+\frac{0,465m}{171}\)
Lại có phương trình tổng khối lượng hỗn hợp X:
\(m_X=m=m_{Na}+m_K+m_{Ba}+m_O\\ =0,18.23+\frac{0,044m}{56}.39+\frac{0,93m}{171}.137+m_O\)
Thay số mol Oxi tính được (theo m) ở trên vào ta được phương trình 1 ẩn m
giải ra được \(m\approx25,5\)

1)
\(n_{CO2}=0,2\left(mol\right)\)
\(n_{NaOH}=2\left(mol\right)=n_{OH^-}\)
\(\frac{n_{OH^-}}{n_{CO2}}=15\rightarrow\) Chỉ tạo muối cacbonat, kiềm dư
\(PTHH:2NaOH+CO_2\rightarrow Na_2CO_3+H_2O\)
\(\rightarrow n_{NaOH_{pu}}=0,4\left(mol\right),n_{Na2CO3}=0,2\left(mol\right)\)
\(n_{NaOH_{du}}=3-0,4=2,6\left(mol\right)\)
\(\rightarrow m=2,6.40+0,2.106=125,2\left(g\right)\)
2) \(n_{CO2}=0,3\left(mol\right),n_{OH^-}=0,5\left(mol\right)\)
\(\frac{n_{OH^-}}{n_{CO2}}=1,6\rightarrow\) Tạo 2 muối
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(Ca\left(OH\right)_2+2CO_2\rightarrow Ca\left(HCO_3\right)_2\)
Gọi a là mol CaCO3, b là mol Ca(HCO3)2 \(\rightarrow\left\{{}\begin{matrix}a+b=0,25\\a+2b=0,3\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,05\end{matrix}\right.\)
\(\rightarrow m_{CaCO3}=100.0,2=20\left(g\right)\)
Câu 1 :
nCO2 = 0.2 mol
nNaOH = 0.24 mol
nNaOH/nCO2 = 0.24/0.2 = 1.2 => tạo ra 2 muối
Đặt : nNa2CO3 = x mol
nNaHCO3 =y mol
<=> 2x + y = 0.24
x + y = 0.2
=> x = 0.04
y= 0.16
mM = m = 0.04*106+0.16*84=17.68 g
Câu 2 :
nCO2 = 0.3 mol
nCO2/nCa(OH)2 = 0.3/0.25= 1.2 => Tạo ra 2 muối
Đặt :
nCaCO3 = x mol
nCa(HCO3)2 = y mol
<=> x + y = 0.25 mol
x + 2y = 0.3
=> x = 0.2
y = 0.05
mCaCO3 = 0.2*100=20 g

Tham khảo:
Câu hỏi của trần đông tường - Hóa học lớp 10 | Học trực tuyến

Đáp án D
Lượng CO 2 tham gia phản ứng và lượng Ba ( OH ) 2 ở hai thí nghiệm đều bằng nhau, nhưng ở TN1 thu được lượng kết tủa ít hơn ở TN2. Suy ra ở TN1 kết tủa đã bị hòa tan một phần. Dựa vào tính chất của đồ thị ở TN1 suy ra :
n CO 2 = 2 n Ba ( OH ) 2 - n BaCO 3 = ( 2 a - 0 , 1 ) mol
Đồ thị biểu diễn sự biến thiên lượng kết tủa theo lượng CO 2 ở TN1 và TN2 :
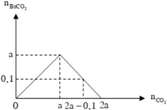
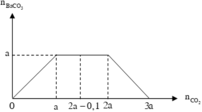
Dựa vào 2 đồ thị, ta thấy a < 2a - 0,1 < 2a nên ở TN2 kết tủa đạt cực đại. Suy ra :
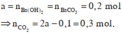
Vậy V = 6,72 lít và a = 0,2 mol

Bài 12. Cho m gam FeCO3 tác dụng với dung dịch HNO3 đặc nóng (dư) thu được hỗn hợp khí X. Hấp thụ hoàn toàn X vào dung dịch Ca(OH)2 0,05 M dư thì thấy có V lít dung dịch Ca(OH)2 phản ứng và thu được 2 gam kết tủa. Giá trị m và V là:
A. 3,2 gam và 0,5 lít B. 2,32 gam và 0,6 lít
C. 2,22 gam và 0,5 lít D. 2,23 gam và 0,3 lít

Số mol Ba(OH)2 là 0,2.2=0,4.
Số mol kết tủa BaCO3 thu được là 39,4/197=0,2.
\(n_{CO_2}=n_{OH-}-n_{CO^{2-}_3}=0,4.2-0,2=0.6\left(mol\right)\).
⇒ V=0,6.22,4=13,44 (lít).