Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hòa tan hỗn hợp 1,69g Oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được Vml dung dịch KOH 1M. Giá trị của V là:
A.20
B.40
C.30
D.10
Giải thích:
\(H2SO4.3SO3+H2O=4H2SO4\)
\(n\left(o\le um\right)=0.005mol\)
\(\Rightarrow nH2SO4=0.005.4=0.02mol\)
\(H2SO4+2KOH=K2SO4+H2O\)
\(\Rightarrow nKOH=0.04\)
\(\Rightarrow\) Giá trị của V là: 40

Đáp án:
8,625 g
Giải thích các bước giải:
nCl2=22,4/22,4=1 mol
nNaOH=0,1x2=0,2 mol
nCa(OH)2=0,1x0,5=0,05 mol
2NaOH+Cl2->NaCl+NaClO+H2O
0,2 0,1 0,1
2Ca(OH)2+2Cl2->CaCl2+Ca(ClO)2+2H2O
0,05 0,05 0,025
m=0,025x111+0,1x58,5=8,625 g

áp dụng công thức
v = ΔC\Δt = 0,22 - 0,1 \ 4 = 0,03 (M\s)�‾=Δ�Δ�=0,22−0,14=0,03(��)

1: \(HCl+NaHCO_3\rightarrow NaCl+CO_2\uparrow+H_2O\)
2: Tính axit của HCl mạnh hơn H2CO3 vì HCl đẩy được H2CO3 ra khỏi dung dịch muối

Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Chúc bạn học tốt!!!

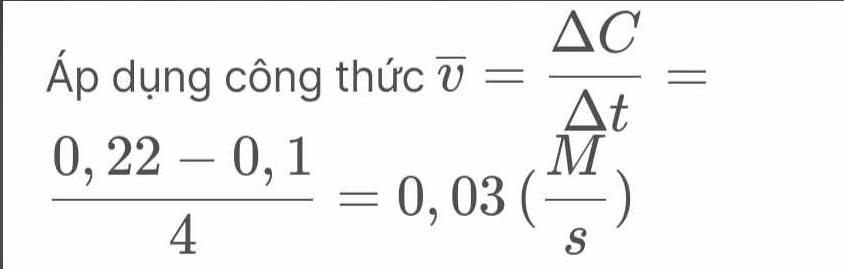


a)
- Dùng quỳ tím
+) Quỳ tím hóa đỏ: HCl
+) Quỳ tím hóa xanh: NaOH
+) Quỳ tím không đổi màu: NaCl và NaNO3
- Đổ dd AgNO3 vào 2 dd còn lại
+) Xuất hiện kết tủa: NaCl
PTHH: \(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\downarrow\)
+) Không hiện tượng: NaNO3
Câu 2 :
Cho quỳ tím lần lượt vào từng chất :
- Hóa xanh : NaOH
- Hóa đỏ : HCl
- Không HT : NaNO3 . NaCl
Cho dung dịch AgNo3 vào 2 chất còn lại :
- Kết tủa trắng : NaCl
- Không HT : NaNO3
b/
+) Cho quỳ tím ẩm lần lượt vào từng lọ khí :
- Hóa đỏ sau đó mất màu : Cl2
- Hóa đỏ : HCl
- Không HT : O2
+) Cho quỳ tím ẩm lần lượt vào từng lọ khí :
- Hóa đỏ sau đó mất màu : Cl2
Cho Ag vào 3 lọ khí còn lại :
- Hóa đen : O3
Cho tàn que đóm đỏ vào 2 lọ khí còn lại :
- Bùng cháy : O2
- Tắt hẳn : N2