Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
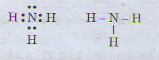

Theo đề ta có hệ:
\(\left\{{}\begin{matrix}2P_M+N_M+4P_X+2N_X=186\\2P_M-N_M+4P_X-2N_X=54\\P_M+N_M-P_X-N_X=21\\2P_M+N_M-2-2P_X-N_X-1=27\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}P_M=26\\N_M=30\\P_X=17\\N_X=18\end{matrix}\right.\)
Vậy M là Fe ; X là Cl
CHe (M) :1s22s22p63s23p64s2
CHe(M2+) :1s22s22p63s23p6
CHe (X) : 1s22s22p63s23p5
CHe(X-) :1s22s22p63s23p6

Theo đề bài, ta có:
n + p + e = 34 (1)
n + 10 = p + e (2)
số p = số e (3)
Thay (2) vào (1), ta có:
(1) => n + n + 10 = 34
2n = 34 - 10
2n = 24
n = 24 : 2
n = 12 (4)
Thay (4) và (3) vào (2), ta có:
(2) => p + p = 12 + 10
2p = 22
p = 22 : 2
p = 11
=> Nguyên tử R có số p = 11 là Natri - Na là nguyên tố kim loại có NTK = 23 đvC

*Cấu hình e của X: 1s2 2s2 2p6 (Ne)
Nằm ở ô số 10, chu kì 2 nhóm VIIIA, là khí hiếm
*Cấu hình e của Y: 1s2 2s2 2p6 3s1 (Na)
Nằm ở ô số 11, chu kì 3 nhóm IA, là kim loại kiềm
*Cấu hình e của Z: 1s2 2s2 2p4 (O)
Nằm ở ô số 8, chu kì 2 nhóm VIA, là phi kim

Xác định X+
X+ có 10 electron nên tổng proton trong 5 hạt nhân là 11
Z = 2,2. Vậy có 1 nguyên tử là H
Gọi nguyên tử thứ hai trong X+ là R, công thức X+ có thể là;
RH4+ : ZR + 4 = 11 → ZR = 7 (N) ; X+: NH4+ (nhận)
R2H3+ : 2ZR + 3 = 11 ZR = 4 loại : R3H2+ : 3ZR + 2 = 11 ZR = 3 loại
Xác định Y2-
Y2- có 32 eletron nên tổng số hạt proton trong 4 nguyên tử là 30.
= 7,5 2 nguyên tử trong Y2- đều thuộc cùng chu kỳ 2.
Gọi 2 nguyên tử là A, B: ZB = ZA +2
Công thức Y2- có thể là
AB32- : ZA + 3ZB = 30
ZB= ZA +2 ZA= 6 (C); ZB = 8 (O)
A2B22- : 2ZA+ 2ZB = 30
ZB = ZA + 2 ZA= 6,5; ZB = 8,5 loại
A3B2- : 3ZA + ZB = 30
ZB = ZA + 2 ZA = 7; ZB = 9 loại
Hợp chất A có công thức (NH4)2CO3
Ta có trong X+ nhé
Có 2 nguyên tố là a và b
Vì có 5 hạt nhân tức là có 5 nguyên tử mà chỉ có 10 e -> Chắc chắn phải có Hidro ( chứ nếu sang tới B là có tới 3 e rồi!)
Biện luận về số nguyên tử hidro và số e của nguyên tố còn lại (ntcl)<--- lưu ý là ion X+ có 10 -> tổng 2 nguyên tố có đến 11 e
Số Hidro : 1------2------3-----4
Số ntcl : 4------3------2-----1
Số e của ntcl:2.5----3------4-----7
Ta thấy chỉ có giá trị 4-1-7 là phù hợp bởi vì 2,5 lẻ bị loại, 3,4 là các nguyên tố kim loại ko tạo ion với Hiđro
Tra bảng tuần hoàn ta có số hiệu 7 là nguyên tố Nitơ. -> X+ là NH4+
Tổng số e trong Y 2- là 32 <=> tổng số e của 4 nguyên tố tạo nên Y2- là 30
Gọi số e của nguyên tố thứ nhất là a thì̀ số e của nguyên tố thứ 2 là a+2
lại gọi thêm số nguyên tử của 2 nguyên tố lần lượt là x,y thì ta có
x+y=4
xa + y(a+2) = 30 <=> xa + ya =28 - 2y <=> (x+y)a= 28 - 2y <=> 4a = 28 - 2y
biện luận
y-----1---------2---------3
a----6.5-----6.25------6
tới đây dừng vì y<4 ta thấy có 1 nguyên tố có 1 nguyên tử mang số hiệu 6 (oxi) -> nguyên tố còn lại mang số hiệu 8 (cacbon) và có 3 nguyên tử -> Y2- là CO3(2-)
-> A chính là ..... (NH4)2CO3

1/Đặt Z, N lần lượt là số hạt p, n có trong nguyên tử M
ta có hệ phương trình
\(\begin{cases}2Z+N=79+3\\2Z-N=19+3\end{cases}\)\(\Rightarrow\begin{cases}Z=26\\N=30\end{cases}\)
a. Cấu hình electron nguyên tử của M là: 1s22s22p63s23p63d64s2
M ở ô thứ 26, chu kì 4 nhóm VIIIB trong bảng tuần hoàn.
b. Cấu hình electron của ion Fe2+ là: 1s22s22p63s23p63d6
Cấu hình electron của ion Fe3+ là: 1s22s22p63s23p63d5
2.
Vì R tạo được hợp chất khí với H nên R là phi kim.
Giả sử R thuộc nhóm x (x\(\ge\)4).
Theo giả thiết
công thức của R với H là RH8-x \(\Rightarrow\)a=\(\frac{R}{R+8-x}.100\)
công thức oxit cao nhất của R là R2Ox
\(\Rightarrow\) b=\(\frac{2R}{2R+16x}.100\) \(\Leftrightarrow\) b= \(\frac{R}{R+8x}.100\)
suy ra \(\frac{a}{b}=\frac{R+8x}{R+8-x}=\frac{11}{4}\)\(\Leftrightarrow R=\frac{43x-88}{7}\)
Xét bảng
x R 4 5 6 7 12 có C 18,14 loại 24,28 loại 30,42 loại
a/ Vậy R là C
b/
Công thức của R với H là CH4
Công thức electron C : H : H : H : H ; Công thức cấu tạo C - H - - - H H H
Oxti cao nhất của R là CO2
Công thức electron O:: C ::O; Công thức cấu tạo O=C=O
c.
Trong hợp chất CH4 có \(\Delta\chi=\chi_C-\chi_H\)=2,55-0,22=0,35<0,4 nên liên kết giữa C-H là liên kết cộng hóa trị không cực
Trong hợp chất CO2 có 0, \(\Delta\chi=\chi_O-\chi_C\) =3,44-2,55=0,89
\(\Rightarrow\) 0,4<\(\Delta\chi=0,89\)<1,7 nên liên kết giữa C=O là liên kết cộng hóa trị phân cực

\(\left\{{}\begin{matrix}P_A+P_B=25\\P_B-P_A=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P_A=12\\P_B=13\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}Z_A=P_A=12\\Z_B=P_B=13\end{matrix}\right.\)
=> A là magie (ZMg=12); B là nhôm (ZAl=13)
Cấu hình e của magie: 1s22s22p63s2
=> Chu kì 3, nhóm IIA, ô 12.
Cấu hình e của nhôm: 1s22s22p63s23p1
=> Chu kì 3, nhóm IIIA, ô 13
=> Magie có tính khử, tính kim loại mạnh hơn nhôm.
Nhôm có tính oxi hoá và tính kim loại mạnh hơn magie.