Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Khi cho khí \(SO_2\) vào dung dịch \(H_2SO_4\) sẽ không có hiện tượng gì xảy ra.
b) Khi để dung dịch \(H_2S\) ngoài không khí một thời gian thì trong ống nghiệm đựng dung dịch \(H_2S\) có xuất hiện kết tủa vàng \(\left(S\right)\) vì đã xảy ra phản ứng: \(H_2S+\frac{1}{2}O_2\rightarrow H_2O+S\downarrow\)
c) Khi nhỏ từ từ dung dịch \(H_2SO_4\) vào ống nghiệm chứa bột \(Na_2SO_3\) thì xuất hiện hiện tượng sủi bọt khí và khí bay ra có mùi hắc \(\left(SO_2\right)\)vì đã xảy ra phản ứng:
\(H_2SO_4+Na_2SO_3\rightarrow Na_2SO_4+H_2O+SO_2\uparrow\)
d) Khi cho dung dịch \(H_2SO_4\) loãng vào ống nghiệm chứa mẫu \(FeCl_2\) không xảy ra bất cứ hiện tượng gì.
e) Khi cho \(H_2SO_4\) đặc vào đường saccarozơ thì đường saccarozơ từ màu trắng chuyển sang màu đen, bắt đầu có cột đen đùn lên cao do xảy ra phản ứng:
\(C_{12}H_{22}O_{11}\underrightarrow{H_2SO_4\left(đ\right)}12C+11H_2O\\ C+2H_2SO_4\rightarrow CO_2+2SO_2+2H_2O\)

A
Đưa lưu huỳnh đang cháy ngoài không khí vào bình đựng khí O 2 thì lưu huỳnh cháy sáng hơn, cho sản phẩm là S O 2 (lưu huỳnh đioxit).
![]()

nZn = 0,65 / 65 = 0,01 mol.
nS = 0,224 /32 = 0,007 mol.
Phương trình hóa học của phản ứng
Zn + S →to ZnS
nZn phản ứng = 0,07 mol.
nZnS = 0,07 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
nZn = 0,65 / 65 = 0,01 mol.
nS = 0,224 /32 = 0,007 mol.
Phương trình hóa học của phản ứng
Zn + S →to ZnS
nZn phản ứng = 0,07 mol.
nZnS = 0,07 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

a)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có (mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl = %.
%mFe = 50,91 %.
Theo lượng chất :
%nAl = 66,67%.
%Fe = 33,33%.
)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có
(mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl =
%.
%mFe = 50,91 %.
Theo lượng chất :

a) Hai phương pháp điều chế H2S từ những chất trên.
Fe + S -> FeS (1)
FeS + H2SO4 -> FeSO4 + H2S (2)
Fe + H2SO4 -> FeSO4 + H2 (3)
H2 + S -> H2S (4)
b) Vai trò của S trong phản ứng (1), (4) : S là chất oxi hóa.
Đỗ Hương Giang21 tháng 4 2017 lúc 19:40
a) Hai phương pháp điều chế H2S từ những chất trên.
Fe + S -> FeS (1)
FeS + H2SO4 -> FeSO4 + H2S (2)
Fe + H2SO4 -> FeSO4 + H2 (3)
H2 + S -> H2S (4)
b) Vai trò của S trong phản ứng (1), (4) : S là chất oxi hóa.

Đáp án A.
2CuS + 3O2 → 2CuO + 2SO2 ↑ (1)
(mol) a → a
2ZnS + 3O2 → 2ZnO + 2SO2 ↑ (2)
(mol) b → b
SO2 + I2 + 2H2 O → H2SO4 + 2HI (3)
(mol) 0,01 0,01
Khối lượng của hỗn hợp: ZnS và CuS là:
![]()
![]()
Gọi a là số mol của CuS và b là số mol của ZnS
Ta có: 96a + 97b = 0,968
a + b = 0,01
=> a = 0,002, b = 0,008 (mol)
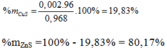

PT:
Fe + S-->FeS (to)
FeS + H2SO4-->H2S + FeSO4
Vai trò:chất oxi hóa
Chọn B