Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 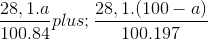 = 0,2
= 0,2
=> a = 29,89.

Chọn đáp án D
Vì thu được H2 khi cho X phản ứng với KOH Þ Có Al dư Þ Toàn bộ oxit Fe đã bị khử về Fe
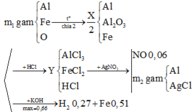
Xét phần 2: Bảo toàn nguyên tố: nKOH = nKAlO2 = nAl + 2nAl2O3 = 0,66
nAl dư trong 0,5X = 0,27/1,5 = 0,18 Þ nAl phản ứng = 2nAl2O3 = 0,66 - 0,18 = 0,48
Rắn không tan chính là Fe Þ nFe = 28,56/56 = 0,51 Þ m1/2 = 28,56 + 0,24x102 + 0,18x27 = 57,9.
Xét phần 1: nH+ trong Y = 0,06x4 = 0,24
BTĐT Þ nCl- = 0,66x3 + 0,51x2 + 0,24 = 3,24 = nAgCl
BTE Þ nAg = 0,51 - 0,06x3 = 0,33 Þ m2 = 0,33x108 + 3,24x143.5 = 500,58
Vậy m1 + m2 = 57,9x2 + 500,58 = 616,38.

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)



Chọn đáp án C.
Từ tỉ lệ nAl: nFe3O4 = 4 : 1 => Đặt nAl = 4x và nFe3O4 = x => 27×4x + 232x = 20,4 => x = 0,06
Đặt nNO = x => nHCl dư trong Y = 4x
nHCl phản ứng = 2×0,24 + 2×0,34 = 1,16 => nAgCl = 1,16 + 4x
BTE => 0,24×3 + 0,06 = 2×0,34 + 3x + nAg => nAg = 0,1 - 3x
=> 184,51 = 143,5×(l,16 + 4x) + 108×(0,l - 3x) =>x = 0,029
Vậy V = 1000×0,029×22,4 = 649,6.