


Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


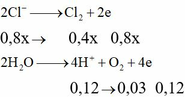


Đáp án A
nCu2+ = 1,2a ; nCl = 0,8a
nNO = 0,03 mol => nH+ = nHNO3 = 0,12 mol
nFe = 0,2 mol
Cu(NO3)2 + 2NaCl -> Cu + Cl2 + 2NaNO3
0,4a 0,8a 0,4a 0,4a
Cu(NO3)2 + H2O -> Cu + 0,5O2 + 2HNO3
0,06 0,06 0,03 0,12
mgiảm = 64(0,4a + 0,06) + 71.0,4a + 32.0,03 = 10,2
=> a = 0,1
=> nCu2+ dư = 1,2a – 0,4a – 0,06 = 0,02 mol
Bảo toàn electron : 2nFe = 3nNO (Vì lượng Fe quá lớn so với NO sinh ra => Fe chỉ tạo Fe2+)
=> nFe pứ = 0,045 mol
Fe + Cu2+ -> Fe2+ + Cu
0,02 0,02 -> 0,02
=> chất rắn gồm : 0,135 mol Fe và 0,02 mol Cu
=> mrắn = 8,84g

nCu2+ = 1,2a ; nCl = 0,8a
nNO = 0,03 mol => nH+ = nHNO3 = 0,12 mol
nFe = 0,2 mol
Cu(NO3)2 + 2NaCl → Cu + Cl2 + 2NaNO3
0,4a 0,8a 0,4a 0,4a
Cu(NO3)2 + H2O → Cu + 0,5O2 + 2HNO3
0,06 0,06 0,03 0,12
mgiảm = 64(0,4a + 0,06) + 71.0,4a + 32.0,03 = 10,2
=> a = 0,1
=> nCu2+ dư = 1,2a – 0,4a – 0,06 = 0,02 mol
Bảo toàn electron : 2nFe = 3nNO (Vì lượng Fe quá lớn so với NO sinh ra => Fe chỉ tạo Fe2+)
=> nFe pứ = 0,045 mol
Fe + Cu2+ → Fe2+ + Cu
0,02 0,02 → 0,02
=> chất rắn gồm : 0,135 mol Fe và 0,02 mol Cu
=> mrắn = 8,84g
Đáp án A

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

Chọn A
Ta có n e ( trao đổi ) = It 96500 = 0 , 34 mol . Các quá trình điện phân diễn ra như sau:
| Tại catot |
Tại anot |
| Cu2+ + 2e → Cu a mol 2a mol → a mol
|
2Cl- → Cl2 + 2e 0,18 mol 0,09 mol 0,18 mol H2O → 4H+ + O2 + 4e 4b mol ← b mol → 4b mol |
Xét khối lượng giảm sau điện phân ta có:
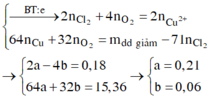
Dung dịch sau điện phân chứa: Na+, H+ (0,24 mol) và NO3- (0,5 mol) và Cu2+ (0,04 mol)
Khi cho dung dịch sau điện phân tác dụng với Fe dư thì:

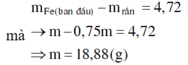

Chọn A.
Khi cho Fe tác dụng với Y thì hỗn hợp rắn gồm Cu và Fe dư.
với nFe pư =
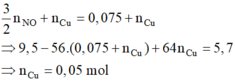
và n H + = 4 n NO = 0 , 2 mol . Dung dịch Y gồm Cu2+ (0,05); H+ (0,2); Na+ (0,5V) và NO3- (2V)
→ BTDT V = 0,2. Dung dịch ban đầu gồm Cu(NO3)2 (0,2 mol) và NaCl (0,1 mol)
Khối lượng dung dịch giảm: m = 64.(0,2 - 0,05) + 71.0,05 + 32.0,05 = 14,75 (g)

Chọn đáp án B
- Ta có
n e t r a o đ ổ i = I t 96500 = 0 , 44 m o l
Quá trình điện phân xảy ra như sau:
| Tại anot |
Tại catot |
| C u 2 + + 2 e → C u 0 , 15 0 , 3 0 , 15 2 H 2 O + 2 e → 2 O H - + H 2 0 , 08 0 , 04 |
2 C l - → C l 2 + 2 e x → 2 x H 2 O → 4 H + + 4 e + O 2 4 x → y |
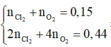

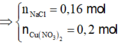
- Dung dịch sau điện phân chứa
![]()
+ Xét dung dịch sau điện phân có:
![]()
mol
- Cho m gam Fe tác dụng với dung dịch trên thì:
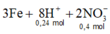
![]()
+ Theo đề ta có: m F e - m r ắ n k h ô n g tan = m F e tan
=> m - 0,8m = 0,09.56 => m = 25,2 (g)