Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
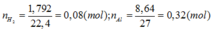
=> nOH- ( do kim loại tạo)= 2nH2 = 0,16 (mol)
Al + OH- + H2O → AlO2- + 3/2H2↑
=> nOH- (dd Y) = nAl = 0,32 (mol)
=> nOH- ( do oxit tạo) = 0,32 – 0,16 = 0,16 (mol)
=> nO (trong oxit) = ½ nOH- ( do oxit tạo ra) = 0,08 (mol)
Vì O chiếm 8%
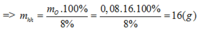
Đáp án D

Đáp án D
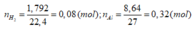
=> nOH- ( do kim loại tạo)= 2nH2 = 0,16 (mol)
Al + OH- + H2O → AlO2- + 3/2H2↑
=> nOH- (dd Y) = nAl = 0,32 (mol)
=> nOH- ( do oxit tạo) = 0,32 – 0,16 = 0,16 (mol)
=> nO (trong oxit) = ½ nOH- ( do oxit tạo ra) = 0,08 (mol)
Vì O chiếm 8%
![]()
n C l 2 = 7 , 84 22 , 4 = 0 , 35 m o l
X – ne → X +n
Cl2+ 2e→ 2Cl
ne (KL nhường) = ne ( Cl2 nhận ) = 0,35.2 = 0,7 (mol)
Khi phản ứng với HCl
X – ne → X +n
2H+ + 2e → H2
ne( H+ nhận ) = ne (KL nhường) = 0,7 (mol)
=> nH+ = 0,7 (mol)
=> mHCl = 0,7.36,5 = 25,55 (g)
m d d H C l = m H C l . 100 % C % = 175 ( g )

1. Gọi x,y lần lượt là số mol của CuO, Fe2O3
Pt: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\) (1)
x \(\rightarrow x\)
Pt; \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\) (2)
y \(\rightarrow y\)
Theo gt: \(\dfrac{n_{CuSO_4}}{n_{Fe_2\left(SO_4\right)_3}}=\dfrac{2}{3}\)
(1)(2) \(\dfrac{n_{CuSO_4}}{n_{Fe_2\left(SO_4\right)_3}}=\dfrac{x}{y}\)
--------------------------- ( múc hai cái lại )
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
\(\Rightarrow x=\dfrac{2y}{3}\)
\(m_{CuO}=\dfrac{2y}{3}.80=\dfrac{160}{3}y\)
\(m_{Fe_2O_3}=160y\)
\(m_{hh}=\dfrac{160}{3}y+160y=\dfrac{640y}{3}\)
\(\%_{CuO}=\dfrac{\dfrac{160}{3}y}{\dfrac{640}{3}y}.100=25\%\)
\(\%_{Fe_2O_3}=\dfrac{160y}{\dfrac{640}{3}y}.100=75\%\)
3. \(n_{H_2SO_4}=0,2.1,5=0,3\left(mol\right)\)
Gọi x,y lần lượt là số mol của Al2O3 ; CaO
Pt: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) (1)
x \(\rightarrow\) 3x
\(CaO+H_2SO_4\rightarrow CaSO_4+H_2O\) (2)
y \(\rightarrow\) y
(1)(2) \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,3\\102x+56y=11,52\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,08\\y=0,06\end{matrix}\right.\)
a) \(m_{Al_2O_3}=0,08.102=8,16\left(g\right)\)
\(m_{CaO}=0,06.56=3,36\left(g\right)\)
b) Pt: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\) (3)
0,08mol \(\rightarrow\) 0,48mol
\(CaO+2HCl\rightarrow CaCl_2+H_2O\) (4)
0,06mol\(\rightarrow\) 0,12mol
(3)(4) \(\Rightarrow\Sigma_{n_{HCl}}=0,48+0,12=0,6\left(mol\right)\)
\(m_{dd_{HCl}}=\dfrac{0,6.36,5}{15}.100=146\left(g\right)\)

Đáp án A
![]()
Từ số mol H2 ta tính được số mol O H - (giải thích:
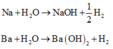
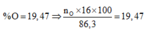
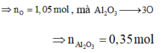
![]()
Ta có phương trình:
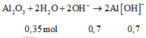
=> dung dịch Y gồm
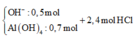
![]()
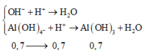
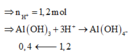
=> Số mol kết tủa còn lại là:
![]()

Đáp án A
%mO/X = 86,3×0,1947 = 16,8 gam.
⇒ nO = 1,05 ⇒ nAl2O3 = 0,35 mol.
Ta có ∑nOH– = 2nH2 = 1,2 mol.
⇒ Dung dịch Y chứa nAlO2– = nAl/Al2O3 = 0,7 mol || nOH dư = 0,5 mol.
+ Sau phản ứng trung hòa nH+ = 3,2×0,75 – 0,5 = 1,9 mol
⇒ nAl(OH)3 = 0,7 – 1 , 9 - 0 , 7 3 = 0,3 mol.
+ Cho 0,3 mol Al(OH)3 phản ứng với KOH ta có phản ứng:
Al(OH)3 + KOH → KAlO2 + 2H2O ||⇒ nKOHcần dùng = 0,3.
⇒ VKOH = 0 , 3 1 , 25 = 0,24 lít = 240 ml

Giải thích:
mO=8,63.19,47/100=1,68 gam=>nO=0,105 mol=>nAl2O3=0,035 mol
nOH-=2nH2=0,12 mol
Al2O3+2OH- → AlO2-+H2O
0,035 0,07(dư 0,05) 0,035
H+ + OH- → H2O
0,05←0,05
H+ + AlO2- + H2O → Al(OH)3
0,07← 0,07 0,07
Al(OH)3+3H+ → Al3+ + H2O
0,04 ←0,12
nAl(OH)3=0,07-0,04=0,03 mol=>m↓=0,03.78=2,34 gam.
Đáp án A

Đáp án D
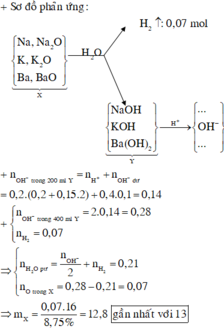
Xử lý dữ kiện 200ml dung dịch Y:
⇒ n O H - d u = 0 , 4 . 0 , 1 = 0 , 04 m o l
⇒ dung dịch Y chứa 0 , 28 m o l O H -
Dễ thấy n O H - = 2 n H 2 + 2 n O / o x i t