Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{COOH\left(X\right)}=n_{CO_2}=0,7mol\)
Khi đốt X có: \(n_{CO_2}=0,4mol;n_{CO_2}=0,8mol\)
Theo ĐLBT oxi có \(n_O=2n_{COOH\left(X\right)}+2n_{O_2}=2n_{CO_2}+n_{H_2O}\)
\(\Rightarrow n_{H_2O}=y=0,6mol\)

Chọn A
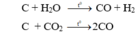
→ n C = n Y – n X = 0,4 (mol)
Bảo toàn electron có: 4. n C pư = 2 . n H 2 + 2 . n CO → n H 2 + n CO = 0,8 (mol)
n CO 2 (Y) = 0,95 – 0,8 = 0,15 mol
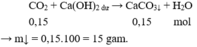

Dễ thấy cả 2 axit đều có 2 H => HCOOH và HCOO - COOH
Đặt số mol 2 chất là x và y,đặt a = 1 thì
x + y = 1
x + 2y = 1,4
=> x = 0,6 ; y = 0,4
=> %mHCOOH = 43,4%

Đáp án D
Sơ đồ quá trình phản ứng:
C + H2O → hh X = {H2; CO; CO2} || X + a mol Fe3O4; b mol CuO → 25,92 gam hh Y.
(2a + 0,5b) mol H2 + hh Y → {Fe; Cu} + H2O.
Gọi số mol {CO; H2} trong X là z mol → cần đúng z mol O trong oxit đề → {CO2; H2O}.
→ 160a + 80b = 25,92 + 16z (1). Lại có để chuyển hết (3a + b) mol O trong oxit → {CO2; H2O}
thì cần vừa đủ z + 2a + 0,5b mol hh {CO; H2} → 3a + b = z + 2a + 0,5b ↔ a + 0,5b = z (2).
Từ (1) và (2) ta có z = 0,18 mol. Đến đây có 2 hướng xử lí:
cách 1: thường các bạn sẽ tìm mối ràng buộc nữa thì C + H2O → CO + H2 || C + 2H2O → CO2 + 2H2.
Bằng cách gọi số mol C ở các pt lần lượt là x, y mol → 2x + 3y = 0,2 mol
và 2x + 2y = nhh CO + H2 0,18 mol. Giải tìm ra đáp án C. ♣.
Theo hướng này có thể nhanh hơn như sau: nCO2 = 0,2 - z = 0,02 mol.
Thay vào 2 phương trình trên cũng ra kết quả tương tự.
cách 2: có thể đi theo hướng sau: hiểu rõ vấn đề + rút gọn suy nghĩ, cần hình dung:
C + H2O →....→.... cuối cùng sẽ thu được CO2 + H2O.
như vậy 0,18 mol O là ở trong CO2 luôn → có 0,09 mol C.
→ trong Y có 0,09 mol CO và CO2 (bảo toàn C) → có 0,11 mol H2O
→ mY = 0,09 × 44 + 0,11 × 18 - 0,18 × 16 = 3,06 gam. → dY/H2 = 3,06 ÷ 0,2 ÷ 2 = 7,65.
Chọn đáp án C.
p/s: bài toán này khai thác điểm đặc biệt Fe2O3 và CuO có M = 160 và 80 + bản chất CO và H2 cùng nhận 1 O.

104,48gam104,48gam
Giải thích các bước giải:
Sơ đồ phản ứng:
⎧⎪ ⎪ ⎪⎨⎪ ⎪ ⎪⎩AlMgFeOFe3O4+HNO3−−−−−→⎧⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎨⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎩NO,N2OH2O⎧⎪⎨⎪⎩Al(NO3)2Mg(NO3)2Fe(NO3)2to→⎧⎨⎩Al2O3MgOFe2O3+NO2+O2{AlMgFeOFe3O4→+HNO3{NO,N2OH2O{Al(NO3)2Mg(NO3)2Fe(NO3)2→to{Al2O3MgOFe2O3+NO2+O2
Oxi chiếm 20,22%20,22% khối lượng hỗn hợp.
mO=25,32%.25,32=5,12gammO=25,32%.25,32=5,12gam
→nO=0,32mol→nO=0,32mol
Gọi số mol của NONO và N2ON2O lần lượt là xx và yy mol
⎧⎨⎩x+y=3,58422,4=0,16mol30x+44y=0,16.2.15,875→{x=0,14y=0,02{x+y=3,58422,4=0,16mol30x+44y=0,16.2.15,875→{x=0,14y=0,02
Quy đổi hỗn hợp X thành các nguyên tố: Al,Mg,Fe,OAl,Mg,Fe,O
→mKl=25,32−5,12=20,2g→mKl=25,32−5,12=20,2g
→mO(cr)=30,92−20,2=10,72gam→mO(cr)=30,92−20,2=10,72gam
→nO=0,67mol→nO=0,67mol
3nAl+3nFe+2nMg=2nO(cr)3nAl+3nFe+2nMg=2nO(cr)
Gọi số mol của NH4NO3NH4NO3 là xx mol
Bảo toàn e:
3nAl+3nFe+2nMg=2nO+8nNH4NO3+3nNO+8nN2O3nAl+3nFe+2nMg=2nO+8nNH4NO3+3nNO+8nN2O
0,67.2=2.0,32+8nNH4NO3+3.0,14+0,02.80,67.2=2.0,32+8nNH4NO3+3.0,14+0,02.8
→nNH4NO3=0,015mol→nNH4NO3=0,015mol
Khối lượng muối:
m=mKl+mNO−3+mNH4NO3m=mKl+mNO3−+mNH4NO3
=20,2+0,67.2.62+0,015.80=104,48gam
Chọn C
Theo bài ra có khối lượng chất rắn giảm chính bằng khối lượng O bị lấy ra khỏi oxit.
Bảo toàn electron: