

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



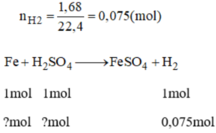
Theo phương trình phản ứng ta có:
n F e = n H 2 = 0,075 mol
n H 2 S O 4 = 0,075 mol (mà H 2 S O 4 đề cho là 0,2 mol nên H 2 S O 4 dư)
![]()

a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Ta có: \(n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,075\left(mol\right)\Rightarrow m_{Fe}=0,075.56=4,2\left(g\right)\)
c, \(n_{H_2SO_4\left(pư\right)}=n_{H_2}=0,075\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2-0,075=0,125\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(dư\right)}=0,125.98=12,25\left(g\right)\)

a) Fe + 2HCl -> FeCl2 + H2 (1)
b) nFe = \(\dfrac{5,6}{56}\) = 0,1(mol)
So sánh tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\) => HCl dư, bài toán tính theo Fe
Theo PT (1) ta có: n\(H_2\) = nFe = 0,1(mol)
=> V\(H_2\) = 0,1.22,4 = 2,24(l)
c) Theo PT (1) ta có: n\(FeCl_2\) = nFe = 0,1(mol)

a) nFe=0,45mol
PTHH: 2Fe+O2=>2FeO
0,45->0,225
=> VO2 cần dùng =0,225.22,4=5,04 lít
b)2KClO3=>2KCl+3O2
0,15<---------------0,225
=> mKClO3=0,15.122,5=18,375g
A.
Số mol của Fe: n=\(\frac{m}{M}\) =\(\frac{25,2}{56}\) = 0.45 (mol)
2Fe + O2 --t0-> 2FeO
Theo PT 2 : 1 : 2
Theo bài ra 0.45 : 0.225 : 0.45 (mol)
Thể tích Oxi tham gia phảm ứng: V = n . 22,4 = 5.04 ( lít )
B.
Ta có: 2KClO3 -t0-> 2KCl + 3O2
Theo PT 2 : 2 : 3
Theo bài ra 0,15 : 0,15 : 0,225 (mol)
Khối lượng KClO3 : m = n.M = 0.15 . 122,5 = 18,375 (g)

Câu 1)
a) 2HgO\(-t^0\rightarrow2Hg+O_2\)
b)Theo gt: \(n_{HgO}=\frac{2,17}{96}\approx0,023\left(mol\right)\\ \)
theo PTHH : \(n_{O2}=\frac{1}{2}n_{HgO}=\frac{1}{2}\cdot0,023=0,0115\left(mol\right)\\ \Rightarrow m_{O2}=0,0115\cdot32=0,368\left(g\right)\)
c)theo gt:\(n_{HgO}=0,5\left(mol\right)\)
theo PTHH : \(n_{Hg}=n_{HgO}=0,5\left(mol\right)\\ \Rightarrow m_{Hg}=0,5\cdot80=40\left(g\right)\)
Câu 2)
a)PTHH : \(S+O_2-t^0\rightarrow SO_2\)
b)theo gt: \(n_{SO2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
theo PTHH \(n_S=n_{SO2}=0,1\left(mol\right)\\ \Rightarrow m_S=0,1\cdot32=3,2\left(g\right)\)
Ta có khối lượng S tham gia là 3,25 g , khối lượng S phản ứng là 3,2 g
Độ tinh khiết của mẫu lưu huỳnh là \(\frac{3,2}{3,25}\cdot100\%\approx98,4\%\)
c)the PTHH \(n_{O2}=n_{SO2}=0,1\left(mol\right)\Rightarrow m_{O2}=0,1\cdot32=3,2\left(g\right)\)

Phương trình hoá học:
Fe3O4 + 4CO −to→ 3Fe + 4CO2 (1)
Fe2O3 + 3H2 −to→ 2Fe + 3H2O (2)
Từ (1) → nCO = 0,8 (mol)
→ VCO = 22,4 x nCO = 22,4 x 0,8 = 17,92 (lít)
Và nH2= 0,6 (mol) → VH2= 22,4 x nH2 = 22,4 x 0,6 = 13,44 (lít).
Từ (1) → nFe/(1) = 0,6 (mol) → mFe/(1) = 0,6 x 56 = 33,6 (gam).
Từ (2) → nFe/(2) = 0,4 (mol) → mFe/(2) = 0,4 x 56 = 22,4 (gam).

a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)