
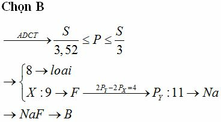
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

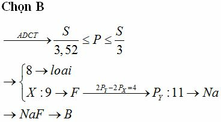

Ta có
Số proton là : p = e = z
Số neutron là n
Gọi số p, n và e ở X là z1 ; n1; e1
Tương tự như vậy vs Y ta có z2 ; n2 ;e2
Ta có:
2z1 + n1 + 2z2 + n2 = 122 (1)
Y có số n nhiều hơn X là 16 => n2 - n1 = 16 (2)
Số p ở X = 1/2 số p ở Y => 2z1 = z2 (3)
Mà số khối của X bé hơn Y là 29 => n2 - n1 + z2 - z1 =29 (4)
Thế (2) vào (4) => 16 + z2 - z1 = 29 <=> z2 - z1 = 13 . Sau đó thế tiếp vào (3) , ta có:
z1 = 13; z2 = 26
Thế z1 ; z2 vào (1) ta có:
78 + n1 + n2 = 122 <=> n1 + n2 = 44
và kết hợp với (2), áp dụng tìm 2 số khi biết tổng và hiệu, ta có:
n1 = 14; n2 = 30
Vậy X là Al ; Y là Fe
Thử lại xem KQ có khớp vs các dữ liệu của đề bài ko nha.

Thành phần chính của thuốc muối là natri hiđrôcacbonat, CTHH: NaHCO3. Trong dạ dày thường chứa dung dịch axit. Người bị đau dạ dày là người có nồng độ dung dịch axit HCl cao làm dạ dày bị bào mòn. NaHCO3 dùng để làm thuốc trị đau dạ dày vì nó làm giảm hàm lượng dung dịch HCl có trong dạ dày nhờ có phản ứng hóa học.
NaHCO3 + HCl → NaCl + CO2 + H2O
Thành phần chính của thuốc muối nabica là natri hidrocacbonat (NaHCO3).
Cơ chế hoạt động của thuốc: Trong dạ dày có 1 lượng axit HCl giúp hòa tan các loại muối khó tan trong quá trình ăn uống. Khi axit dạ dày tăng cao, nếu uống thuốc muối nabica thì NaHCO3 trong thuốc muối tác dụng với axit HCl trong dạ dày theo phương trình hóa học:
NaHCO3 + HCl \(\rightarrow\) NaCl + CO2\(\uparrow\) + H2O.
Lượng axit thừa trong dạ dày đã tác dụng với NaHCO3 có trong thuốc muối nabica, do vậy không còn, nhờ vậy người bị ợ chua, thừa axit không còn bị như vậy nữa.

Số hiệu là 11
Cấu tạo nguyên tử: Na
Tính chất hóa học đặc trưng là kim loại hoạt động mạnh
Tính chất hóa học của A mạnh hơn Mg, Al
ài 4. Nguyên tố A có số hiệu nguyên tử là 11, chu kì 3, nhóm I trong bảng tuần hoàn các nguyên tố hoá học. Hãy cho biết:
- Cấu tạo nguyên tử của A.
- Tính chất hoá học đặc trưng của A.
- So sánh tính chất hoá học của A với các nguyên tố lân cận.
giải
Số hiệu là 11
Cấu tạo nguyên tử: Na
Tính chất hóa học đặc trưng là kim loại hoạt động mạnh
Tính chất hóa học của A mạnh hơn Mg, Al

số hạt mang điện = (122 + 34) : 2 = 78
số hạt ko mang điện = 122 - 78 = 44
số hạt mang điện ở ngtố X là: 78 : 3 = 26 => p = e = 13 hạt
số hạt mang điện ở ngtố Y là: 78 - 26 = 52 => p = e = 26 hạt
số hạt ko mang điện ở ngtố X là: (44 - 16) : 2 = 14
số hạt ko mang điện ở ngtố Y là: 44 - 14 = 30
=> X là ngtố nhôm; Y là ngtố sắt

- Gọi số mol của Y là a và của Z là b mol.
- Gọi Y,Z lần lượt là nguyên tử khối của Y,Z.
- Ta có: Y-Z=8
- Mặt khác: mY=mZ=44,8/2=22,4
-Nên b>a suy ra b-a=0,05 hay b=0,05+a
-Ta có Y-Z=8 hay 22,4/a-22,4/b=8 hay 22,4/a-22,4/(a+0,05)=8
-Biến đổi ra phương trình bậc 2: a2+0,05a-0,14=0 giải ra hai nghiệm: a=0,35(nhận) và a=-0,4(loại)
- Từ đó có: a=0,35 và b=0,4 nên Y=22,4/a=22,4/0,35=64(Cu) và Z=22,4/b=22,4/0,4=56(Fe)

Các nguyên tố nhóm VIIA có tính chất hóa học tương tự clo.
Br2 + 2K 2KBr
3Br2 + 2Fe 2FeBr3
Br2 + H2 2HBr (k)
Bài 4. Các nguyên tố nhóm VII đều là những phi kim mạnh tương tự clo (trừ At): tác dụng với hầu hết kim loại tạo muối, tác dụng với hiđro tạo hợp chất khí. Viết phương trình hoá học minh hoạ với brom.
Lời giải:
Các nguyên tố nhóm VIIA có tính chất hóa học tương tự clo.
Br2 + 2K 2KBr
3Br2 + 2Fe 2FeBr3
Br2 + H2 2HBr (k)

Câu 1: Cho luồng khí H22 (dư) qua hỗn hợp các oxit CuO, Fe22O33, ZnO, MgO nung ở nhiệt độ cao. Sau khi các phản ứng xảy ra hoàn toàn, hỗn hợp chất rắn còn lại là
A. Cu, FeO, ZnO, MgO
B. Cu, Fe, Zn, MgO
C. Cu, Fe, ZnO, MgO
D. Cu, Fe, Zn, Mg
Câu 2: Dãy gồm các chất đều phản ứng với nước là:
A. Fe2O3, CO2, N2O
B. Al2O3, BaO, SiO2
C. CO2, N2O5, BaO
D. CO2, CO, BaO
Câu 3: Dãy gồm các chất đều được với dung dịch NaOH là:
A. N2O5, CO2, Al2O3
B. Fe2O3, Al2O3, CO2
C. CO3, N2O5, CO
D. N22O55, BaO, CuO
Câu 4: Dãy gồm các chất đều phản ứng với dung dịch HCl tạo thành sản phẩm có chất khí là
A. NaOH, Al, Zn
B. Fe(OH)22, Fe, MgCO33
C. CaCO33, Al22O33, K22SO33
D. BaCO3, Mg, K2SO3
Câu 5: Dãy chất nào sau đây có thể cùng tồn tại trong một dung dịch?
A. NaCl, CuSO4, AgNO3
B. CuSO4, MgCl2, KNO3
C. AgNO3, KNO3, NaCl
D. KNO3 BaCl2, Na2CO3
Câu 6: Phát biểu nào sau đây là đúng?
A. Các phi kim thường dẫn điện, dẫn nhiệt tốt
B. Các phi kim chỉ tồn tại ở trạng thái rắn và trạng thái khí
C. Các phi kim thường có nhiệt độ nóng chảy thấp
D.Các phi kim đều ít tan trong nước, đều rất độc
Câu 7: Có ba chất cacbon oxit,hidro clorua, clo đựng trong ba bình riêng biệt. CHỉ dùng thuốc thử nào sau đây có thể nhận biết được ba bình khí nói trên?
A. dd NaOH B. dd phenolphtalein C. giấy quỳ tím ẩm D. Đồng (II) oxit
Câu 8: Vật dụng nào sau đây không nên dùng để đựng vôi vữa?
A. chậu nhựa B. chậu nhôm C. chậu đồng D. chậu sắt tây
Câu 9: Phát biểu nào sau đây không đúng?
A. Nhiều phi kim tác dụng với oxit tạo thành oxit axit
B. Các phi kim tác dụng với hiđro đều tạo thành hợp chất khí
C. Các phi kim tác dụng với kim loại đều tạo thành muối
D. Phần lớn các phi kim không dẫn nhiệt, không dẫn điện
Câu 10: Phát biểu nào sau đây đúng?
A. Trong một chu kì, đi từ đầu chu kì tới cuối chu kì theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
B. Số thứ tự của một nguyên tố trong bảng tuần hoàn luôn bằng số đơn vị điện tích hạt nhân, bằng số proton, bằng số electron và bằng số nơtron trong nguyên tử của nguyên tố
C. Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau
D. Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần nguyên tử khối