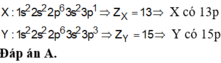Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

không trong câu này , đáp án C là đúng , vì ở phân lớp 3d , số e tối đa là 10 e , vậy cấu hình đầy đủ của nó phải là cấu hình ở phương án C bạn nhé .
chúc bạn hok tốt .![]()

Đáp án : D
X có e cuối thuộc phân lớp s => nhóm A(I hoặc II)
Y có e cuối thuộc phân lớp p => nhóm A (III à VIII)
, eX + eY = 20 => pX + pY = 20
Ta có : X chỉ có thể là : H( p =1) ; He (p =2) ; Na(p = 11) và K(p = 19)
=> Ta thấy Chỉ có Na (p = 11) => pY = 9 (Flo) thỏa mãn
=> X – Y : NaF ( liên kết ion )

Các bạn chú ý, khi tính ra E(\(\pi\)) = 1,7085.10-18 thì đơn vị là J2s2/kg.m2 chứ không phải là đơn vị (J), sau đó nhân với NA và nhân với 10-3 thì mới ra được kết quả là 1,06.103 kJ/mol.
bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với

a) Nguyên tử photpho có 15e.
b) Sô' hiệu nguyên tử của p là : 15.
c) Lớp thứ 3 có mức năng lượng cao nhất.
d) p là phi kim vì có 5e ở lớp ngooài cùng.

Công thức tổng quatscuar số hạng nguyên tử là:\(^{^{2s+1}}X_j\)
+ với Cu ta có cấu hình e:\(^{1s^22s^22p^63s^23p^64s^13d^{10}}\) số e độc thân N=1 =>s=\(\frac{N}{2}=0.5\)
\(L=\Sigma ml=0\) =>X là S , mặt khác số e phân lớp ngoài cùng điền vào các ô lượng tử bằng 1 nửa trạng thái bão hòa =>j=|L-s|=0.5
Số hạng nguyên tử của Cu là \(^2S_{0.5}\)
+ với Cr ta có cấu hình e :\(^{1s^22s^22p^63s^23p^64s^13d^5}\) số e độc thân N=6 => s=N/2=3
\(L=\Sigma ml=0\) suy ra X là S
Mặt khác ta có số e điền ở phân lớp ngoài cùng băng 1 nửa trạng thái bão hòa =>j=|L-s|=3
số hạng nguyên tử của Cr là \(^7S_3\)
+ với Ag ta có cấu hình e :\(1s^22s^22p^63s^23p^64s^23d^{10}4p^65s^14d^{10}\) số e độc thân N=1 =>s=N/2=0.5
\(L=\Sigma ml=0\) suy ra X là S
Số e điền ở phân lớp ngoài cùng bằng 1 nửa trạng thái bão hòa => j=|L-s|=0.5
Suy ra số hạng nguyên tử của Ag là :\(^2S_{0.5}\)
+ với Au ta có cấu hình e:\(1s^22s^22p^63s^23p^64s^23d^{10}4p^65s^24d^{10}5p^66s^14f^{14}5d^{10}\) số e độc thân là N=1 => s=N/2=0.5
\(L=\Sigma ml=0\) suy ra X là S
Số e điền vào phân lớp ngoài cùng chỉ băng 1 nửa trạng thái bão hòa =>j=|L-s|=0.5
Suy ra số hạng nguyên tử của Au là :\(^2S_{0.5}\).
Ta có: Cu: 1s\(^2\)2s\(^2\)2p\(^6\)3s\(^2\)3p\(^6\)4s\(^1\)3d\(^{10}\)
N=1, S=\(\frac{N}{2}\)=\(\frac{1}{2}\)=> 2s+1= 2; L=0; J= L+S=\(\frac{1}{2}\) => S\(^2_{\frac{1}{2}}\)
Cr: 1s\(^2\)2s\(^2\)2p\(^6\)3s\(^2\)3p\(^6\)4s\(^1\)3d\(^5\)
N=6, S=\(\frac{N}{2}\)=3, => 2s+1= 7; L=0; J=|L-S|=|0-3|=3 => S\(^7_3\)
Au: 1s\(^2\)2s\(^2\)2p\(^6\)3s\(^2\)3p\(^6\)4s\(^2\)3d\(^{10}\)4p\(^6\)5s\(^2\)4d\(^{10}\)5p\(^6\)6s\(^2\)4f\(^{14}\)5d\(^9\)
N=1, S=\(\frac{N}{2}\)=\(\frac{1}{2}\), => 2s+1= 2, L= 2, J=L+S= 2+ \(\frac{1}{2}\)=\(\frac{5}{2}\) => D\(^2_{\frac{5}{2}}\)
Ag: 1s\(^2\)2s\(^2\)2p\(^6\)3s\(^2\)3p\(^6\)4s\(^2\)3d\(^{10}\)4p\(^6\)5s\(^1\)4d\(^{10}\)
N=1, S=\(\frac{1}{2}\), 2s+1=2, L=0, J= \(\frac{1}{2}\) => S\(^2_{\frac{1}{2}}\)

a) - 1s22s22p4 ; Số electron hóa trị là 6.
- 1s22s22p3 ; Số electron hòa trị là 5.
- 1s22s22p63s23p1 ; Số electron hòa trị là 3.
- 1s22s22p63s23p5 ; Số electron hòa trị là 7.
b)
- 1s22s22p4 ; Nguyên tố thuộc chu kì 2 nhóm VIA.
- 1s22s22p3 ; Nguyên tố thuộc chu kì 2 nhóm VA.
- 1s22s22p63s23p1 ; Nguyên tố thuộc chu kì 3 nhóm IIIA.
- 1s22s22p63s23p5 ; Nguyên tố thuộc chu kì 3 nhóm VIIA.
a) - 1s22s22p4 ; Số electron hóa trị là 6.
- 1s22s22p3 ; Số electron hòa trị là 5.
- 1s22s22p63s23p1 ; Số electron hòa trị là 3.
- 1s22s22p63s23p5 ; Số electron hòa trị là 7.
b)
- 1s22s22p4 ; Nguyên tố thuộc chu kì 2 nhóm VIA.
- 1s22s22p3 ; Nguyên tố thuộc chu kì 2 nhóm VA.
- 1s22s22p63s23p1 ; Nguyên tố thuộc chu kì 3 nhóm IIIA.
- 1s22s22p63s23p5 ; Nguyên tố thuộc chu kì 3 nhóm VIIA.

Ta có: cos 450 = \(\frac{\text{ λ}}{\text{ λ}'}=\frac{\text{ λ}}{0,22}\)
=> λ = cos450.0,22 = 0.156Ǻ
Thưa thầy, thầy chữa bài này được không ạ. Thầy ra lâu rồi nhưng chưa có đáp án đúng

Chi có K và Ca, còn lại các nguyên tố nhóm B đều có e cuối điền vào 3d chứ không phải 4s
=> Đap an C