Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Y công thức Oxit cao nhất là YO3 Y có hóa trị VI
Y thuộc nhóm VIA
Mặt khác Y thuộc chu kì 3 Y là S Hợp chất M là MS
M chiếm 63,64% khối lượng:
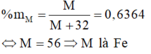

Giả sử: M số proton và nơtron lần lượt là p và n
=> Khối lượng nguyên tử của M: mp.p+mn.n
X có số p và n lần lượt là p và n
=> Khối lượng nguyên tử của X là: mp.p +mn.n
( mp và mn lần lượt là khối lượng của 1 hạt proton và 1 hạt nơtron)
Mà mp =mn = 1,67.10^-27 nên
Khối lượng nguyên tử của M: mp.( n+p)
Khối lượng nguyên tử của X : mp.(n + p )
(+++: Vì khối lượng của 1 nguyên tử là tổng khối lượng của p, e và n, mà khối lượng của e không đáng kể nên khối lượng của nguyên tử có thể tính bằng khối lượng của p và n)
* ta có:
n-p = 4 <=> n=p+4 (1)
n =p (2)
p+ xp = 58 => xp = 58 - p (3)
* Hợp chất A có công thức MX(x) trong đó M chiếm 46,67% về khối lượng nên:
M / (M+xX) = 46,67/100 <=> [mp.(n+p)] / [mp.(n+p) + x.mp.(n +p )] = 46,67/100
<=> (n+p) / [(n+p) +x(n +p )] = 46,67/100 (4)
Thay (1), (2), (3) vào (4) ta giải ra được : p = 26 => Kim loại M chính là Fe
p=26 => n= 26 +4 = 30 và xp = 32
Với x=1 => p =32 => phi kim là Ge (loại )
Với x=2 => p =16 => phi kim là S( thuộc chu kì 3 nên thỏa mãn điều kiên=> chọn)
Vậy công thức của hợp chất A là: FeS2

CT oxit cao nhất là YO3.
⇒ Y có hóa trị cao nhất với oxy = 6
Vậy Y ở nhóm VIA, chu kỳ 3.
Cấu hình e-: 1s2 2s2 2p6 3s2 3p4.
ZY là 16 (S) ⇒ MY : MS
Mặt khác: MM+32=63,64100⇒M=56 (Fe)
Nguyên tố Y là phy kim thuộc chu kì 3 , có công thức oxit cao nhất là YO3 \(\Rightarrow Y\)là \(S\)
Nguyên tố S tạo bởi 2 kim loại M hợp chất có CT MS
\(\%M=\frac{M_M}{M_M+32}=63,64\%\Rightarrow M_M=56\Rightarrow M\)là \(Fe\)

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

*Xác định Y:
Y thuộc chu kì 2 => Y có 2 lớp e
Công thức oxit cao nhất của Y là YO2
=> Y có hóa trị IV
=> Y thuộc nhóm IVA
=> Y có 4e lớp ngoài cùng
=> Cấu hình e của Y: 1s22s22p2
=> Y là Cacbon
*Xác định M:
Hợp chất MC2
\(\%m_C=\dfrac{2.12}{M+2.12}.100=37,5\%\)
=> M=40 (Ca)
Vậy M là Ca

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hiđro của nó là RH2, trong phân tử RH2, có 5,88% H về khối lượng
nên R có 100 - 5,88 = 94,12% về khối lượng
Trong phân tử RH2, có: 5,88% H là 2u
94,12% R là x u
Giải ra ta có x ≈ 32. Nguyên tử khối của R = 32. R là S. Công thức phân tử là SO3 và H2S.

Bài này tương tự, tham khảo.
Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168% lượng A. Biết khối lượng khí B bằng 44% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài làm
Gọi kim loại hóa trị II là R, có nguyên tử khối là R (R > 0), x là số mol của RO (x > 0)
Theo bài ra ta có các PTHH :
RO + H2SO4 \(\rightarrow\) RSO4 + H2O
RCO3 + H2SO4 \(\rightarrow\) RSO4 + CO2\(\uparrow\) + H2O
Giả sử khối lượng của A đem tham gia p.ứng là 100g thì khối lượng RSO4 = 168g và khối lượng CO2 = 44g \(\approx\) 1 mol.
Theo giả sử ta có : (R + 16)x + R + 60 = 100 (1)
Theo phương trình ta có : (R + 96)x + R + 96 = 168 (2)
Từ (1), (2) \(\Rightarrow\) x = 0,4
R \(\approx\) 24 \(\Rightarrow\) Mg
Phần trăm khối lượng của oxit là : %MgO = 16%
Phần trăm khối lượng của muối là : %MgCO3 = 84%
chép mạng . Không tính. Mới có lớp 7 làm sao nổi hóa lớp 8 chứ không ns đến lớp 10

Đáp án C
Y công thức Oxit cao nhất là YO3 ⇒ Y có hóa trị VI
⇒ Y thuộc nhóm VIA
Mặt khác Y thuộc chu kì 3 ⇒ Y là S ⇒ Hợp chất M là MS
M chiếm 63,64% khối lượng: