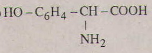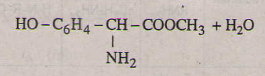Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Dáp án C
Trong các chai dung dịch đạm có nhiều các axit amin mà cơ thể cần khi bị ốm, mất sức hoặc sau các ca phẫu thuật để cơ thể sớm hồi phục. Ngoài ra có các chất điện giải và có thể thêm một số các vitamin, sorbitol tùy theo tên thương phẩm của các hãng dược sản xuất khác nhau

Đáp án C
- Trong các chai dung dịch đạm có nhiều các axit amin mà cơ thể cần khi bị ốm, mất sức hoặc sau các ca phẫu thuật để cơ thể sớm hồi phục. Ngoài ra có các chất điện giải và có thể thêm một số các vitamin, sorbitol tùy theo tên thương phẩm của các hãng dược sản xuất khác nhau.

Câu a:
Có 3 dd là: H2O, NaOH, HCl
Cho quỳ tím vào:
\(\rightarrow\) Hóa đỏ: HCl
\(\rightarrow\) Hóa xanh: NaOH
\(\rightarrow\) Không chuyển màu: H2O
Câu b:
Có 4 dd: H2O, Ca(OH)2 (ở dạng dd), H2SO4 loãng, NaCl.
+ Cho quỳ tím vào:
\(\rightarrow\) Hóa xanh: dd Ca(OH)2
\(\rightarrow\) Hóa đỏ: H2SO4 loãng
\(\rightarrow\) Không chuyển màu quỳ tím: H2O và NaCl -----nhóm A
Với nhóm A:
- Cách 1:
Cho dd AgNO3 vào mỗi chất trong nhóm A:
\(\rightarrow\) Tạo kết tủa với AgNO3: NaCl
NaCl + AgNO3 \(\rightarrow\)AgCl\(\downarrow\) + NaNO3
\(\rightarrow\) Không hiện tượng: H2O
Nếu bạn chưa học tới thì có thể dùng cách 2:
- Cách 2:
Lấy ít mẫu thử của H2O và NaCl đun nóng.
\(\rightarrow\) Bay hơi hết : H2O
\(\rightarrow\) Bay hơi còn lại chất rắn kết tinh : NaCl
a, trích 3 mau thử ra 3 ống nghiệm có mẩu quỳ tím
chất lam cho quỳ tím hóa đỏ là HCl
chất lam quý tím xanh la NaOH
còn lại quỳ tím ko đổi mau la H2O

а) (1) 2A1 + O2 Al2O3
(2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(3) AlCl3 + 3NaOH (vừa đủ) → 3NaCl + Al (OH)3
(4) 2Al(OH)3 Al2O3+ ЗН2О
(5) 2Al2O3 4Al + 3O2
(6) 2Al + 3Cl2 2AlCl3
b) (1) Fe + H2SO4 → FeSO4 + H2
(2) FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2
(3) Fe(OH)2 + 2HCl → FeCl2 + 2H2O
c) (1) 2Fe + 3Cl2 → 2FeCl3
(2) FeCl3 + 3NaOH → 3NaCl + Fe(OH)3
(3) 2Fe(OH)3 → Fe203 + 3H2O
(4) Fe2O3 + 3CO → 2Fe + 3CO2
(5) 3Fe + 2O2 → Fe304

+ Các điều kiện phản ứng
(1) Cộng H2O/xt H+ ; (2) oxi hóa, ví dụ bằng CuO ; (3) tác dụng với clo, ở 4500C ; (4) thủy phân trong môi trường bazơ ; (5) oxi hóa, ví dụ bằng CuO.

Các phương trình hóa học của tirozin:
a) 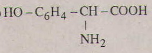
b) 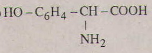
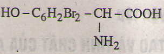
c) 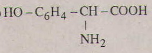
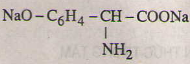
d)