Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Đặt 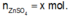
n Zn OH 2 TN 1 n Zn OH 2 TN 2 = m Zn OH 2 TN 1 m Zn OH 2 TN 2 = 3 a 2 a = 3 2 ⇒ n Zn OH 2 TN 1 = 3 y , n Zn OH 2 TN 2 = 2 y
Từ giả thiết, suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Ở TN1 có thể kết tủa đã bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 Zn OH 2 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
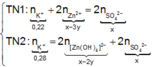
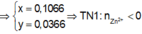 loại
loại
● Nếu ở TN1 Zn OH 2 đã bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
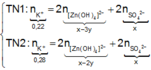
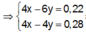
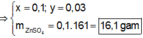

Đáp án B
Đặt
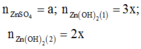
-Xét ở thí nghiệm 1
+ Nếu ![]() thì tạo thành kết tủa và kết tủa tan một phần
thì tạo thành kết tủa và kết tủa tan một phần
Và ở thí nghiệm 2 kết tủa cũng tan một phần
TN1: dung dịch sau phản ứng có ion:
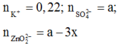
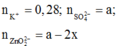
BTĐT:
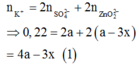
TN2: dung dịch sau phản ứng có ion:
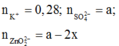
BTĐT:
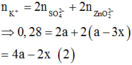
![]()
![]()
Với trường hợp ![]() thì không thỏa mãn
thì không thỏa mãn

Đáp án A
Từ giả thiết suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Còn ở TN1 thì có thể có hiện tượng hòa tan kết tủa hoặc chưa. Ta đặt :
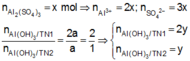
● Nếu cả TN1 và TN2 đều có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
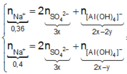
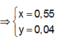
![]() thỏa mãn
thỏa mãn
Suy ra : ![]()
● Nếu TN1 chưa có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
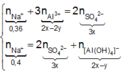
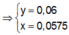
![]() (loại)
(loại)

nOH- = 0,04 mol
Vì nAlO2- = 0,02 mol mà chỉ thu được 0,01 mol kết tủa nên nHCl = 4n kết tủa + nAlO2- dư = 0,05 mol
=> tổng nH+ = 0,09 mol => V = 45ml
Vậy : B đúng
H+ + OH- => H2O 1
0,02......0,02
H+ + AlO2 - + H2O => Al(OH)3 2
0,02.....0,02.........................0,02
3H+ + Al(OH)3 => Al3+ +3H2O 3
0,03.........0,01
do cần V lớn nhất nên xét TH tạo kết tủa xong hòa tan 1 phần kết tủa
n Al(OH)3 =0,01 => nAl(OH)3 ở 3 =0,01
=> nHCl= 0,03 +0,02 +0,02 =0,07 => V=0,035 => C

Đặt a, b, c là số mol Al203, CuO , FeO mA = 102a + 80b + 72c = 20,3 m rắn = 102a + 64b + 56c = 17,1 nHCl = 6a + 2b + 2c = 0,7 -> a = 0,05 ; b = c = 0,1 Trong B chứa nCO2 = b + c = 0,2 nCaCO3 = 0,1 -> nCa(HCO3)2 = 0,05 -> nCa(OH)2 = 0,15 -> Vdd =105 ml

Quy đổi hỗn hợp thành RCOOH
nRCOOH= 2nH2=0,5 mol => nOtrong axit=2nRCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 mol
CO2 + Ba(OH)2---> BaCO3+ H2O
nBa(OH)2=0,7 mol < nCO2 => Ba(OH)2 hết và CO2 dư
=> m Kết tủa = 0,7*(MBaCO3)=137,9 gam.
nCOOH= nNaHCO3=nCO2=0,5 mol => nOtrong axit=2nCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 => mCO2=44

Coi như hỗn hợp X chỉ gồm Na, K, Ba, O
Cho X vào nước thì 3 kim loại phản ứng sinh ra khí H2, còn O tác dụng với H2 để tạo ra nước theo tỷ lệ 1Oxi+1H2
\(\Rightarrow\) \(n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_O=0,14\left(mol\right)\)
Có \(n_{Na}=n_{NaOH}=0,18\left(mol\right)\)
\(n_K=n_{KOH}=\frac{0,044m}{56};n_{Ba}=n_{Ba\left(OH\right)_2}=\frac{0,93m}{171}\left(mol\right)\)
\(\Rightarrow n_O=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_{H_2}=0,09+\frac{0,022m}{56}+\frac{0,465m}{171}\)
Lại có phương trình tổng khối lượng hỗn hợp X:
\(m_X=m=m_{Na}+m_K+m_{Ba}+m_O\\ =0,18.23+\frac{0,044m}{56}.39+\frac{0,93m}{171}.137+m_O\)
Thay số mol Oxi tính được (theo m) ở trên vào ta được phương trình 1 ẩn m
giải ra được \(m\approx25,5\)


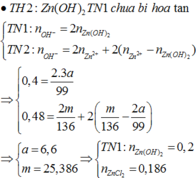
Đáp án B
Đặt
Từ giả thiết, suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Ở TN1 có thể kết tủa đã bị hòa tan hoặc chưa bị hòa tan.
Nếu ở TN1 Zn(OH)2 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
Từ (*) suy ra : TN1 đã có hiện tượng hòa tan kết tủa : Không thỏa mãn.
Vậy ở TN1 Zn(OH)2 đã bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :