
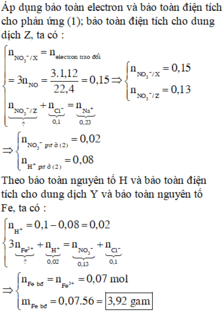
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


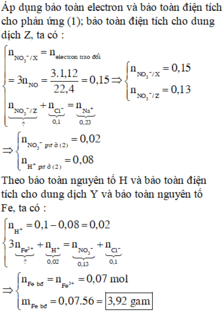

Đáp án C
0,3 mol NaOH phản ứng với dung dịch Y: cuối cùng Natri đi về đâu?
À, trong 0,15 mol NaCl (bảo toàn Cl) và còn lại là 0,15 mol trong NaNO3.
Nhẩm nhanh ở phản ứng Fe + HNO3 → 0,006 mol NO
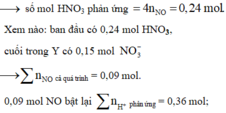
mà tổng HNO3 ban đầu với HCl thêm vào là 0,39 mol.
→ Chứng tỏ rằng trong Y còn dư 0,03 mol H+ nữa.
Rõ hơn quan sát sơ đồ tổng:
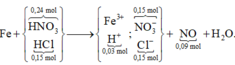
Áp dụng định luật bảo toàn điện tích trong dung dịch Y → số mol Fe là 0,09 mol
→ m = 5,04 gam.

Fe được hòa tan hoàn toàn bởi dd HNO3 thu được dd X, khi thêm HCl vào X có khí NO thoát ra → trong X có ion Fe2+ → HNO3 đã phản ứng hết
n(NO) = \(\frac{0,672}{22,4}\) = 0,03mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 4H2O
0,03___0,12____________0,03
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
x___________________3x
Theo ĐL bảo toàn nguyên tố, số mol NO3- có trong muối:
n(NO3- trong muối) = n(HNO3) - n(NO) = 0,09mol
n(NaOH) = 0,1.1,3 =0,13mol
Sau khi NaOH pư hoàn toàn với các chất trong dd Y, dung dịch thu được có:
n(Na+) = n(NaOH) = 0,13mol; n(Cl-) = n(HCl) = 0,05mol
→ n(NO3-) = n(Na+) - n(Cl-) = 0,13 - 0,05 = 0,08mol
→ Số mol NO3- bị Fe2+ khử: 0,09 - 0,08 = 0,01mol
NO3- + 3Fe2+ + 4H+ → 3Fe3+ + NO + 2H2O
0,01___0,03____0,04
NO3- và H+ đều dư (H+ dư 0,01mol) → Fe2+ đã phản ứng hết → 3x = 0,03 → x = 0,01mol
Tổng số mol Fe: n(Fe) = 0,03 + x = 0,04mol
Khối lượng Fe đã sử dụng: m(Fe) = 0,04.56 = 2,24g

Áp dụng định luật bảo toàn khối lượng ta có:
\(m=m_{ACl_n}+m_{BCl_m}=m_{A+B}+m_{HCl}-m_{H_2}\)
Áp dụng bảo toàn nguyên tố:
nHCl phản ứng = 2nH2 = 0,2 mol
Ta có m = 10 + 0,2 x 36,5 - 0,2 = 17,1 (g)
Chọn đáp án B

Cho m gam hỗn hợp X gồm ( Fe , FeO , Fe2O3 ) có tỷ lệ khối lượng tương ứng là 7:18:40 .Hỗn hợp X tan vừa hết trong 500 ml H2SO4 loãng 0,68 M thu được dung dịch B và thoát ra V lít khí H2 ( đktc). Cho dung dịch B tác dụng NaOH dư lọc kết tủa nung khô trong không khí thu được 22,4 gam chất rắn. Giá trị của V là ?
A. 0,448
B. 0,896
C. 2,24
D. 1,12

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

Mình ko phải giáo viên đâu!!!!
Đối với những bài có quá nhiều chất cậu nên quy ước về các nguyên tố rồi áp dụng bảo toàn e là đơn giản nhất!!!![]()
Bài giải:
Fe \(\rightarrow\) Fe+3 + 3e 4H+ + NO3- + 3e => NO +2 H2O
Gọi n Fe= a mol ta có: nNO => nH+ (trong ax) =>nH+ =0,12+0,05 = 0,17 mol
dễ nhận thấy: nH+ (dư) + 3nFe = nNaOH => (0,17-4a) + 3a = 0,13 => a=0,04 mol
=> dd Y có : 0,04 mol Fe3+ và 0,01 mol H+ (dư)
khi cho Cu vào Y thì có các PƯ sau:
Fe3+ + 1e => Fe2+ ; Cu => Cu2+ + 2e ; 4H+ + NO3- + 3e => NO + 2 H2O
áp dụng định luật bảo toàn e ta có: 0,04 + \(\frac{3}{4}\) 0,01 = 0,0475 mol (e nhường) => nCu=0,02375 mol
Vậy m Cu=0,02375.64= 1,52 (g)
bài này nhiều chỗ mình trình bày chưa chặt chẽ mong các bạn và thầy cô đóng góp ý kiến!!!!!!!

N+5 +1e =>N+4
0,02 mol<=0,02 mol
2N+5 +2.4e =>2N+1
0,04 mol<=0,01 mol
ne nhận=ne nhường=0,06 mol
nNO3- tạo muối=ne nhận=0,06 mol
=>mNO3-=0,06.62=3,72g
mKL=5,04g=>m muối=m gốc KL+mNO3-=3,72+5,04=8,76g
nHNO3 =0,06+0,02+0,005.2=0,09 mol
=>CM dd HNO3=0,09/0,1=0,9M
Phương trình nhận electron:
N+5 + 8e → N2O
N+5 +1e→NO2
nNO tạo muối = nNO + 8nN2O = 0,02 + 8.0,005 = 0.02 + 0,04 = 0,06 mol
mNO tạo muối =0,06.62 = 3,72g
m =mKL+ mNO tạo muối = 5,04 + 3,72 = 8,76g
nHNO3 tham gia phản ứng = 2nNO + 10nN2O = 2.0,02 + 10.0,005= 0,09 mol
x =0.09:0,1=0,9M ==>> Đáp án thứ nhất