Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Đáp án A
Giả sử số mol ban đầu:
nAl = x mol, nBa(OH)2 = y mol
2Al + Ba(OH)2 + 2H2O→ Ba(AlO2)2 + 3H2
x 0,5x 0,5x
Dung dịch X: Ba(AlO2)2 (0,5x mol) và Ba(OH)2 dư (y-0,5x mol)
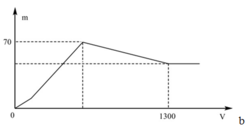
+ Khi kết tủa lớn nhất:
m↓ = mAl(OH)3 max + mBaSO4 max = 78x + 233y = 70 (1)
+ Khi V= 1300 ml: Al(OH)3 vừa bị hòa tan hết.
Khi đó ta có:
OH- + H+ → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
nH+ = nOH- dư + nAlO2- + 3nAl(OH)3 max
=> 2.1,3.0,5 = 2y – x + x + 3x
<=> 3x + 2y = 1,3 (2)
Giải (1) và (2): x = 0,3; y = 0,2
=> a = 0,3.27 = 8,1 gam

M + H2SO4 ® MSO4 + H2(0,05 mol) ® nSO4 = nH2 = 0,05 mol.
® m = mM + mSO4 = 2,43 + 96.0,05 = 7,23 gam.

Coi như cho cả X và H2SO4 cùng lúc vào dd kiềm (vừa đủ) thì kết quả sinh ra vẫn là muối và nước. Dung dịch sau cùng chưa các ion: \(H_2N-C_xH_y-\left(COO\right)^{2-};K^+;Na^+;SO_4^{2-}.\)
Có ngay: \(n_{H^+}=n_{OH^-}=2n_X+2n_{H_2SO_4}=0,4\left(mol\right)\)
Mà \(n_{K+}=3n_{Na+}\Rightarrow n_{K+}=0,3\left(mol\right);n_{Na+}=0,1\left(mol\right)\)
\(m_{H_2N-C_xH_y-\left(COO\right)^{2-}}=m_{muối}-m_{K+}-m_{Na+}-m_{SO_4^{2-}} \\ =36,7-0,3\cdot39-0,1\cdot23-0,1\cdot96=13,1\left(gam\right)\)
\(M_{H_2N-C_xH_y-\left(COO\right)^{2-}}=\frac{13,1}{0,1}=131\\ \Rightarrow M_X=131+2=133\\ \Rightarrow\%N=\frac{14}{133}\cdot100\%\approx10,526\%\)
cho m gam axit glutamicvaof dung dịch NAOH thu được dd X chứa 23,1 gam chất tan . để tác dụng vừa đủ với chất tantrong X cần dùng 200ml dung dịch HCL 1M và H2S4O 0,5M thu được dung dịch chứa 38,4 gam hỗn hợp muối .m=?

Áp dụng định luật bảo toàn khối lượng ta có:
\(m=m_{ACl_n}+m_{BCl_m}=m_{A+B}+m_{HCl}-m_{H_2}\)
Áp dụng bảo toàn nguyên tố:
nHCl phản ứng = 2nH2 = 0,2 mol
Ta có m = 10 + 0,2 x 36,5 - 0,2 = 17,1 (g)
Chọn đáp án B

a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.
a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.

Gọi công thức của Oxit Sắt là : \(Fe_xO_y\)
Các PTHH khi X vào HCl :
\(Fe+2HCl\rightarrow FeCl_2+H_2\)(1)
\(Fe_xO_y+2yHCl\rightarrow FeCl_{\frac{2y}{x}}+yH_2O\) (2)
nHCl ban đầu =\(\frac{200.14,6}{100.36,5}=0.8\left(mol\right)\)
\(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow m_{H_2}=0,1.2=0,2\left(g\right)\)
Từ (1) \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_xO_y}=17,2-5,6=11,6\left(g\right)\Rightarrow n_{Fe_xO_y}=\frac{11,6}{56x+16y}\left(mol\right)\left(3\right)\) Từ (1) \(n_{HCl}=2n_{H_2}=2.0,1=0,2\left(mol\right)\)
\(m_{ddA}=200+17,2-0,2=217\left(g\right)\)
\(m_{ddB}=217+33=250\left(g\right)\)
\(n_{HCldu}=\frac{250.2,92}{100.36,5}=0,2\left(mol\right)\)
\(n_{HCl\left(2\right)}=0,8-0,2-0,2=0,4\left(mol\right)\)
\(n_{Fe_xO_y}=\frac{1}{2y}n_{HCl}=\frac{1}{2y}.0,4=\frac{0,2}{y}\left(mol\right)\)(4)
Từ (3) và (4) ta có pt :\(\frac{11,6}{56x+16y}=\frac{0,2}{y}\Rightarrow\frac{x}{y}=\frac{3}{4}\)
Vậy CT Oxit cần tìm là :Fe3O4
 với các chất sau:
với các chất sau: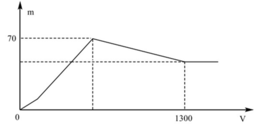
Giải thích:
Giả sử số mol ban đầu: nAl = x mol, nBa(OH)2 = y mol
2Al + Ba(OH)2 + 2H2O→ Ba(AlO2)2 + 3H2
x 0,5x 0,5x
Dung dịch X: Ba(AlO2)2 (0,5x mol) và Ba(OH)2 dư (y-0,5x mol)
+ Khi kết tủa lớn nhất: m↓ = mAl(OH)3 max + mBaSO4 max = 78x + 233y = 70 (1)
+ Khi V= 1300 ml: Al(OH)3 vừa bị hòa tan hết. Khi đó ta có:
OH- + H+ → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
nH+ = nOH- dư + nAlO2- + 3nAl(OH)3 max => 2.1,3.0,5 = 2y – x + x + 3x <=> 3x + 2y = 1,3 (2)
Giải (1) và (2): x = 0,3; y = 0,2
=> a = 0,3.27 = 8,1 gam
Đáp án A