Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Hướng dẫn
Gọi số mol oxit MO = x mol.
MO + H2SO4 → MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu ![]() = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x.
Theo bài: C% (MSO4) = 20% nên: ![]()
Từ đây ta tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO

\(n_{MO}=\frac{m}{M}=\frac{a}{M+16}\left(mol\right)\)
\(PTHH:MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(\Rightarrow n_{H_2SO_4}=n_{MO}=n_{MSO_4}=\frac{a}{M+16}\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}m_{H_2SO_4}=n.M=\left(\frac{a}{M+16}\right).98\left(g\right)\Rightarrow m_{ddH_2SO_4}=\frac{\left(\frac{a}{M+16}\right).98.100\%}{17,5\%}=560\left(\frac{a}{M+16}\right)\left(g\right)\\m_{MSO_4}=n.M=\left(\frac{a}{M+16}\right).\left(M+96\right)\left(g\right)\end{matrix}\right.\)
\(pt:C\%_{ddM}=\frac{m_{MSO_4}}{m_{ddspu}}.100\%=20\%\\ \Leftrightarrow\frac{\left(\frac{a}{M+16}\right)\left(M+96\right)}{a+560\left(\frac{a}{M+16}\right)}.100\%=20\%\\ ...................\\ \Leftrightarrow M=24a\\ Vs.a=1\Rightarrow M=24\left(TM\right)\\ \Rightarrow M:Mg\left(Magie\right)\\ \rightarrow CT.Oxit:MgO\)

Bài này tương tự, tham khảo.
Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168% lượng A. Biết khối lượng khí B bằng 44% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài làm
Gọi kim loại hóa trị II là R, có nguyên tử khối là R (R > 0), x là số mol của RO (x > 0)
Theo bài ra ta có các PTHH :
RO + H2SO4 \(\rightarrow\) RSO4 + H2O
RCO3 + H2SO4 \(\rightarrow\) RSO4 + CO2\(\uparrow\) + H2O
Giả sử khối lượng của A đem tham gia p.ứng là 100g thì khối lượng RSO4 = 168g và khối lượng CO2 = 44g \(\approx\) 1 mol.
Theo giả sử ta có : (R + 16)x + R + 60 = 100 (1)
Theo phương trình ta có : (R + 96)x + R + 96 = 168 (2)
Từ (1), (2) \(\Rightarrow\) x = 0,4
R \(\approx\) 24 \(\Rightarrow\) Mg
Phần trăm khối lượng của oxit là : %MgO = 16%
Phần trăm khối lượng của muối là : %MgCO3 = 84%
chép mạng . Không tính. Mới có lớp 7 làm sao nổi hóa lớp 8 chứ không ns đến lớp 10

8/ Hoà tan một oxit của kim loại (có hoá trị không đổi) bằng dung dịch axit sunfuric có nồng độ 39,2 % vừa đủ thu được dung dịch muối có nồng độ 40,14%.
Tìm công thức của oxit trên.
Bài giải
Gọi x là hóa trị của kim loại
Giả sử khối lượng oxit tham gia pư là 1mol
R2Ox + xH2SO4 ----> R2 (SO4)x +x H2O
1mol x mol 1mol
mR2Ox=(2R+16x)g
mH2SO4=98x g
mddH2SO4=98x*100/39,2=250x g
mdd(spư)=2R+266x g
mR2(SO4)x=2R+96x g
Nồng độ muối sau pư:
(96x+2R)/(2R+266x)=40,14/100
\Leftrightarrow 119,72R=1077,24x
\Leftrightarrow R=9x
Ta thấy x=3, R=27 là thõa mãn
Vậy CT oxit là Al2O3

Lần sau đăng chia nhỏ câu hỏi ra nhé
4.
R+H2SO4\(\rightarrow\)RSO4+H2
a) Ta có
nR=nRSO4
\(\rightarrow\)\(\frac{32,88}{R}\)=\(\frac{55,92}{R+96}\)
\(\rightarrow\)\(\text{R=137}\)
\(\rightarrow\)R là Bari(Ba)
b)
nBa=\(\frac{32,88}{137}\)=0,24(mol)
\(\rightarrow\)nH2=nBa=0,24(mol)
\(\text{VH2=0,24.22,4=5,376(l)}\)
nH2SO4=nBa=0,24(mol)
CMH2SO4=\(\frac{0,24}{0,2}\)=1,2(M)
2.
M+H2SO4\(\rightarrow\)MSO4+H2
nH2=\(\frac{4,48}{22,4}\)=0,2(mol)
nM=nH2=0,2(mol)
M=\(\frac{13}{0,2}\)=65(g/mol)
\(\rightarrow\)M là kẽm (Zn)
3.
M+H2SO4\(\rightarrow\)MSO4+H2
nH2=\(\frac{7,84}{22,4}\)=0,35(mol)
M=\(\frac{14}{0,35}\)=40
\(\rightarrow\)M là Canxi
b)
nCaSO4=nH2=0,35(mol)
\(\text{mCaSO4=0,35.136=47,6(g)}\)

Giả sử số mol của MO là 1 mol
Pt: \(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
1 ----------> 1---------> 1 -----------> 1
\(m_{dd\left(spu\right)}=M+16+\dfrac{98.100}{17,5}=M+576\left(g\right)\)
\(C\%_{MSO_4}=\dfrac{M+96}{M+576}.100=20\%\)
=> M = 24 => M là Mg

giả sử ban đầu có 98g dung dịch H2SO4. Gọi a là số mol của H2SO4
Ta có 10% = 98a.100%/98
=> số mol H2SO4: a = 0,1.
ptpu: MO + H2SO4 ---------------> MSO4 + H2O
0,1 0,1 0,1
Ta có: 11,8 = 0,1.(M + 98).100/[98+(16+M).0,1] => M=24 (Mg)

=
= 0, 025 mol
Phương trình hóa học của phản ứng:
NaBr + AgNO3 → AgBr↓ + NaNO3
X mol x mol x mol
NaCl + AgNO3 → AgCl↓ + NaNO3
Y mol y mol y mol
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dung dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
Ta có hệ phương trình đại số:
Giải ra , ta có x = 0, 009 mol NaBr
→ mNaBr = mNaCl = 103 x 0,009 = 0,927g
C% = x 100% = 1,86%

Đặt kim loại là M, oxit là MO
Giả sử có 1 mol MO phản ứng, 1 mol H2SO4 phản ứng:
MO + H2SO4---- -> MSO4 + H2O
C% = mct / mdd . 100%
10% = 1 . 98 / mdd . 100%
-> mDd H2SO4 = 980 g
Theo định luật bảo toàn khối lượng ta có:
Mdd = mMO + mddH2SO4 = (M + 16) + 980
= M + 996
C%muối = m chất tan muối/ m dd muối . 100%
15.17% = \(\frac{M+96}{M+996}\). 100%
=>M = 64.95 g
=>M là Zn
Công thức oxit ZnO
đặt kim loại là m , oxit là mo
giả sử có 1 mol mo phản ứng , 1 mol h2so4 phản ứng
mo+ h2so4 ---> mso4 +h2o
c% =mct / mdd .100%
10%= 1.98/mdd.100%
---> mdd h2so4 =980g
theo định luât bảo toàn khối lượng ta có
mdd = m mo + mdd h2so4 =( m+16) +980 = m +996
c% muối = m chất tan muối / m dd muối .100%
15.17% =( m=96)/ ( m+ 996) * 100%
m= 64.95g
m là zn
công thức oxit zno
Đáp án A
Hướng dẫn Gọi số mol oxit MO = x mol
MO + H2SO4 ® MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu =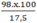 = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x
Theo bài: C% (MSO4) = 20% nên: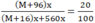
Từ đây tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO