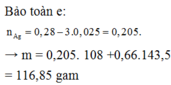Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Quy hỗn hợp thành Fe2O3, FeO và CuO với số mol lần lượt là a b và c.
Ta có sơ đồ phản ứng:
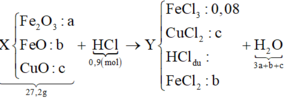
Khi điện phân dung dịch Y đến khi catot thoát khí ⇒ FeCl3 và CuCl2 đã bị điện phân hết.
⇒ mGiảm = nFeCl3×35,5 + nCuCl2×135 = 13,64 gam Û nCuCl2 = 0,08 mol.
⇒ Ta có hệ phương trình
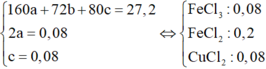
Bảo toàn Clo ⇒ nHCl dư = 0,1 mol.
●Tóm lại sau điện phân dung dịch chứa: nFeCl2 = 0,28 mol và nHCl = 0,1 mol.
Cho dung dịch sau điện phân + AgNO3 ⇒ 3Fe2+ + 4H+ + NO3– → Fe3+ + NO + 2H2O.
⇒ nFe2+ bị mất đi = 0,1 × 3 ÷ 4 = 0,075 mol ⇒ nFe2+ còn lại = 0,28 – 0,075 = 0,205 mol.
⇒ nAg = nFe2+ = 0,205 mol || nAgCl = nCl– = 0,28×2 + 0,1 = mol.
⇒ m↓ = mAg + mAgCl = 0,205×108 + 0,66×143,5 = 116,85

Đáp án B
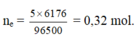
Fe + dung dịch sau điện phân → sinh khí NO
⇒ dung dịch sau điện phân chứa H+⇒ Cl– bị điện phân hết.
► Quy đổi sản phẩm điện phân về CuO và CuCl2 với số mol x và y.
ne = 2x + 2y = 0,32 mol; mdung dịch giảm = 80x + 135y = 15(g).
||⇒ giải hệ có: x = 0,12 mol; y = 0,04 mol ⇒ nKCl = nCl– = 2y = 0,08 mol.
⇒ nCu2+ = nCu(NO3)2 = 0,08 × 3 = 0,24 mol ⇒ nCu2+/dung dịch = 0,08 mol.
nO2 = 0,5x = 0,06 mol ⇒ nH+ = 0,06 × 4 = 0,24 mol.
► 4H+ + NO3– + 3e → NO + 2H2O || Cu2+ + 2e → Cu.
ne nhận tối đa = 3/4nH+ + 2nCu2+ = 0,34 mol < ne cho tối thiểu = 2nFe = 0,5 mol.
||⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2 ⇒ nFe phản ứng = 0,34 ÷ 2 = 0,17 mol.
► Hỗn hợp rắn gồm 0,08 mol Fe và 0,08 mol Cu ⇒ m = 9,6(g).

Đáp án B
ne = 5 x 6176 / 96500 = 0,32 mol. Fe+ dung dịch sau điện phân → sinh khí NO
⇒ dung dịch sau điện phân chứa H+ ⇒ Cl– bị điện phân hết.
► Quy đổi sản phẩm điện phân về CuO và CuCl2 với số mol x và y.
ne = 2x + 2y = 0,32 mol; mdung dịch giảm = 80x + 135y = 15(g).
⇒ giải hệ có: x = 0,12 mol; y = 0,04 mol ⇒ nKCl = nCl– = 2y = 0,08 mol.
⇒ nCu2+ = nCu(NO3)2 = 0,08 × 3 = 0,24 mol ⇒ nCu2+/dung dịch = 0,08 mol.
nO2 = 0,5x = 0,06 mol ⇒ nH+ = 0,06 × 4 = 0,24 mol.
► 4H+ + NO3– + 3e → NO + 2H2O
Cu2+ + 2e → Cu.
ne nhận tối đa = 3/4nH+ + 2nCu2+ = 0,34 mol < ne cho tối thiểu = 2nFe = 0,5 mol.
⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2 ⇒ nFe phản ứng = 0,34 ÷ 2 = 0,17 mol.
► Hỗn hợp rắn gồm 0,08 mol Fe và 0,08 mol Cu ⇒ m = 9,6(g)

Chọn đáp án B.
Dung dịch điện phân chứa 3x mol Cu(NO3)2 và x mol KCl.
Áp dụng định luật điện phân Faraday, ta có ne trao đổi = It : 96500 = 0,32 mol.
Dung dịch điện phân ra x mol CuCl2 và y mol CuO. Ta có: 2x + 2y = 0,32 mol và 135x + 80y = 15 gam
Giải hệ được x = 0,04 mol và y = 0,12 mol
→ dung dịch sau điện phân có Cu(NO3)2; KNO3 và HNO3.
Bảo toàn nguyên tố H có nH2O = 0,12 mol → bảo toàn nguyên tố O có nNO = 0,06 mol.
Tiếp tục bảo toàn N suy ra số mol Fe(NO3)2 là 0,17 mol. Bảo toàn khối lượng kim loại ta có:0,25 x 56 + 0,08 x 64 = 0,17 x 56 + m → m = 9,6 gam

Đáp án B
Dung dịch điện phân chứa 3x mol Cu(NO3)2 và x mol KCl.
Áp dụng định luật điện phân Faraday, ta có ne trao đổi = It ¸ 96500 = 0,32 mol.
Dung dịch điện phân ra x mol CuCl2 và y mol CuO. Ta có: 2x + 2y = 0,32 mol và 135x + 80y = 15 gam.
Giải hệ được x = 0,04 mol và y = 0,12 mol.
® dung dịch sau điện phân có Cu(NO3)2; KNO3 và HNO3.
Bảo toàn nguyên tố H có nH2O = 0,12 mol ® bảo toàn nguyên tố O có nNO = 0,06 mol.
Tiếp tục bảo toàn N suy ra số mol Fe(NO3)2 là 0,17 mol. Bảo toàn khối lượng kim loại ta có: 0,25 x 56 + 0,08 x 64 = 0,17 x 56 + m →m = 9,6 gam