Hoà tan hết 2,3g Na kim loại vào 97,8g nước . Hãy tính nồng độ % của dung dịch thu được sau phản ứng

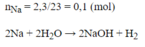
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Hoà tan hết 2,3g Na kim loại vào 97,8g nước . Hãy tính nồng độ % của dung dịch thu được sau phản ứng

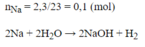


C % N a O H = m N a O H m dd .100 % = 0,1.40 100 .100 % = 4 % .
Đáp án B

Sửa lại :
nNa=0,1
2Na+2H2O-->2NaOH+H2
0,1-----------------0,1-------0,05
=>Cm NaOH=0,1/0,0978=1,02M
mNaOH=4g
=>C% NaOH=4*100/(2,3+97,8-0,05*2)=4%

mik sửa lại cái dưới bị lỗi latex
\(a.n_{HCl}=0,05.2=0,1\left(mol\right);n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\\ 2R+6HCl\rightarrow2RCl_3+3H_2\\ \Rightarrow\dfrac{0,1}{6}>\dfrac{0,03}{3}\Rightarrow HCl.dư,R.pư.hết\\ n_R=0,03.2:3=0,02\left(mol\right)\\ M_R=\dfrac{0,54}{0,02}=27\left(g/mol\right)\\ \Rightarrow R=27\left(Al,nhôm\right)\\ b.C_{M_{AlCl_3}}=\dfrac{0,3.2:3}{0,05}=0,4M\\ C_{M_{HCl\left(dư\right)}}=\dfrac{0,1-\left(0,3.6:3\right)}{0,05}=0,8M\)
\(a.n_{HCl}=0,05.2=0,1\left(mol\right)\\ n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\\ 2R+6HCl\rightarrow2RCl_3+3H_2\\ \Rightarrow\dfrac{0,1}{6}>\dfrac{0,03}{3}\Rightarrow HCl.dư,R.pư.hết\\ n_R=0,03.2:3=0,02\left(mol\right)\\ M_R=\dfrac{0,54}{0,02}=27\left(g/mol\right)\\ \Rightarrow R=27\left(Al,nhôm\right)\\ b.n_{AlCl_3}=n_{Al}=0,02mol\\ C_{M_{AlCl_3}}=\dfrac{0,02}{0,05}=0,4M\\ C_M_{HCl\left(dư\right)}=\dfrac{0,1-\left(0,03.2\right)}{0,05}=0,8M\)

a) Đặt công thức oxít M2On
Ptpư: M2On + nH2SO4 → M2(SO4)n + nH2O
mol 1 n 1
mddH2SO4 = n.98.100/10 = 980n gam
mdd muối = 2M + 996n (gam)
→ C% muối = (2M + 96n) : (2M + 996n) = 0,11243
→ M = 9n → M = 27 (Al)
→ Công thức oxít: Al2O3
b) ptpứ: Al2O3 ---> 2Al + 3/2O2
Al2O3 + 2NaOH ---> 2NaAlO2 + H2O
Al2(SO4)3 + 3Na2CO3 + 3H2O ---> 2Al(OH)3 + 3Na2SO4 + 3CO2

a) Đặt công thức oxít M2On
Ptpư: M2On + nH2SO4 --->M2(SO4)n + nH2O
mol 1 n 1
mddH2SO4 = n.98.100/10 = 980n gam
mdd muối = 2M + 996n (gam)
→ C% muối = (2M + 96n) : (2M + 996n) = 0,11243
→ M = 9n → M = 27 (Al)
→ Công thức oxít: Al2O3
b) ptpứ: Al2O3 ------> 2Al + 3/2O2
Al2O3 + 2NaOH --->2NaAlO2 + H2O
Al2(SO4)3 + 3Na2CO3 + 3H2O --->2Al(OH)3+ 3Na2SO4 + 3CO2

a,\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 2Na + 2H2O → 2NaOH + H2
Mol: x 0,5x
PTHH: Ba + 2H2O → Ba(OH)2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}23x+137y=36,6\\0,5x+y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,4\\y=0,2\end{matrix}\right.\)
\(\%m_{Na}=\dfrac{0,4.23.100\%}{36,6}=25,17\%;\%m_{Ba}=100-25,17=74,83\%\)
b,
PTHH: 2Na + 2H2O → 2NaOH + H2
Mol: 0,4 0,4
PTHH: Ba + 2H2O → Ba(OH)2 + H2
Mol: 0,2 0,2
mdd sau pứ = 36,6+167,2-0,4.2 = 203 (g)
\(C\%_{ddNaOH}=\dfrac{0,4.40.100\%}{203}=7,88\%\)
\(C\%_{ddBa\left(OH\right)_2}=\dfrac{0,2.171.100\%}{203}=16,85\%\)

\(n_{Na_2O}=\dfrac{15,5}{62}=0,25\left(mol\right)\\ PTHH:Na_2O+H_2O\rightarrow2NaOH\\ n_{NaOH}=2.0,25=0,5\left(mol\right)\\ a,C_{MddNaOH}=\dfrac{0,5}{0,5}=1\left(M\right)\\ b,2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ n_{H_2SO_4}=n_{Na_2SO_4}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ m_{H_2SO_4}=0,25.98=24,5\left(g\right)\\ m_{ddH_2SO_4}=\dfrac{24,5.100}{20}=122,5\left(g\right)\\ V_{ddH_2SO_4}=\dfrac{122,5}{1,14}\approx107,456\left(ml\right)\\ c,V_{ddsau}=V_{ddNaOH}+V_{ddH_2SO_4}\approx0,5+0,107456=0,607456\left(l\right)\\C_{MddNa_2SO_4}\approx\dfrac{ 0,25}{0,607456}\approx0,411552\left(M\right)\)

\(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,35_____0,7___________0,35 (mol)
a, \(m_{Zn}=0,35.65=22,75\left(g\right)\)
b, \(C\%_{HCl}=\dfrac{0,7.36,5}{200}.100\%=12,775\%\)