Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(2Fe+6H_2SO_4\text{đặc}\rightarrow^{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2FeO+4H_2SO_4\text{đặc}\rightarrow^{t^0}Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
\(2Fe_3O_4+10H_2SO_4\text{đặc}\rightarrow3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\)
Quy đổi hỗn hợp A gồm x mol Fe và y mol O
\(\Rightarrow56x+16y=49,6\) (1)
\(Fe\rightarrow Fe^{3+}+3e\)
x ------------> 3x
\(S^{+6}+2e\rightarrow S^{+4}\)
..........0,8 <--- 0,4
\(O+2e\rightarrow O^{2-}\)
y --> 2y
\(\Rightarrow3x=2y+0,8\) (2)
Giải hệ (1)(2) được x = 0,7 mol, y = 0,65 mol
\(\Rightarrow\%m_O=\dfrac{16.0,65}{49,6}.100\%=20,97\%\)
Ta có:
\(2H_2SO_4+2e\rightarrow SO_4^{2-}+SO_2\uparrow+2H_2O\)
...............................0,4 <---- 0,4
\(\Rightarrow n_{SO_4^{2-}}\text{tạo muối với cation kim loại}=0,4\) mol
\(\Rightarrow m_{\text{muối}}=m_{\text{kim loại}}+m_{SO_4^{2-}}\text{tạo muối với cation kim loại}\)
\(=56.0,7+96.0,4=77,6\) gam

Ta có : \(56n.Fe+M.n_H=11,12\left(\odot\right)\)
Phần 1 :
Bảo toàn e : \(2.\frac{n_{Fe}}{2}+n.\frac{n_M}{2}=2.n_H\)
\(=2.\frac{3,136}{22,4}=0,26\left(1\right)\)
( n là hóa trị của M )
Phần 2 :
Bảo toàn e : \(3.\frac{n_{Fe}}{2}+n.\frac{n_M}{2}=2.n_{SO2}=2.\frac{4,042}{22,4}\approx0,36\left(2\right)\)
Từ ( 1) và ( 2) \(\rightarrow\frac{n_{Fe}}{2}=0,36-0,28=0,08\left(mol\right)\)
\(\rightarrow n_{Fe}=0,16\left(mol\right)\)
Thay \(\left(\odot\right)\) vào \(\left(1\right)\)
\(\Leftrightarrow\left\{{}\begin{matrix}56.0,16+M.n_M=11,12\\2.0,08+n.\frac{n_M}{2}=0,28\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}n_M=\frac{2,16}{M}\\n_M=\frac{0,24}{n}\end{matrix}\right.\rightarrow\frac{2,16}{M}=\frac{0,24}{n}\)
\(\rightarrow M=\frac{0,16.n}{0,24}=9n\)
Lập bảng :
| n | 1 | 2 | 3 |
| M | 9 | 18 | 27 |
| KL | Loại | Loại | Al |
Vậy M là Al
\(\rightarrow m_{Fe}=56.0,16=8,96\left(g\right)\)
\(\%m_{Fe}=\frac{8,96}{11,12}.100\%=80,58\%\)
\(\%m_{Al}=100\%-80,58\%=19,42\%\)

1.
a/ - Cho dd H2SO4 loãng t/d với Fe.
Fe + H2SO4 -> FeSO4 + H2O
=> H2SO4 có tính chất hóa học (tchh) của axit: t/d với KL đứng trước H sinh ra muối và khí H2.
- Cho dd H2SO4 l~t/d với CuO.
CuO + H2SO4 -> CuSO4 + H2O
=> H2SO4 có tchh của axit: t/d với oxit bazơ tạo ra muối và nước.
- Cho dd H2SO4 t/d với KOH.
2KOH + H2SO4 -> K2SO4 + 2H2O
=> H2SO4 có tchh của axit: t/d với dd kiềm cho ra muối và nước.
b/ - Cho H2SO4 đặc t/d với Cu.
Cu + 2H2SO4 đ --t*--> CuSO4 + SO2 + 2H2O
=> H2SO4 đặc có tchh riêng: t/d được với Cu, sinh ra khí SO2 (KL đứng sau H).
- Cho H2SO4 đặc t/d với Fe.
2Fe + 6H2SO4 đ --t*--> Fe2(SO4)3 + 6H2O + 3SO2
=> H2SO4 đặc có tchh riêng: t/d với KL sinh ra muối và giải phóng SO2; đẩy được Fe lên hóa trị cao nhất.
- Cho H2SO4 đặc vào C6H12O6.
C6H12O6 ----H2SO4 đ, t*---> 6C + 6H2O
=> H2SO4 đặc có tchh riêng: có tính háo nước.
2. Gọi số mol của CuO và ZnO lần lượt là a và b.
n HCl = Cm.V = 3.0,1 = 0,3 mol.
a/ CuO + 2HCl -> CuCl2 + H2O
_1_____2 (mol)
_a_____2a
ZnO + 2HCl -> ZnCl2 + H2O
_1______2 (mol)
_b_____2b
Theo đề bài, ta có hệ phương trình:
80a + 81b = 12,1 (m hh)
2a + 2b = 0,3 (n HCl)
Giải hệ, được: a = 0,05; b = 0,1.
b/ m CuO = n.M = 80a = 80.0,05 = 4 (g).
=> % mCuO = (mCuO / mhh) . 100% = 33,06 %.
=> % mZnO = 100% - 33,06% = 66,94 %.
c/ CuO + H2SO4 -> CuSO4 + H2O
___1______1 (mol)
___0,05__0,05
ZnO + H2SO4 -> ZnSO4 + H2O
_1_____1 (mol)
_0,1__0,1
Tổng số mol H2SO4 = 0,05 + 0,1 = 0,15 mol.
=> m H2SO4 = n.M = 0,15.98 = 14,7 g.
=> mdd H2SO4 = (mct.100%) / C% = (14,7.100)/20 = 73,5 g.

Xét hiệu độ âm điện của các phân tử :
\(H_2\): \(2,20-2,20=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(O_2\): \(3,44-3,44=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(O_3\): \(3,44-3,44=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(H_2O\): \(3,44-2,20=1,24>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(BeCl_2\): \(3,16-1,57=1,59>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CO\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CO_2\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(NH_3\): \(3,04-2,20=0,84>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(PH_3\): \(2,20-2,19=0,01< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(BF_3\): \(3,98-2,04=1,94>1,7\text{ }\Rightarrow\) Liên kết ion.
\(HF\): \(3,98-2,20=1,78>1,7\text{ }\Rightarrow\) Liên kết ion.
\(HCl\): \(3,16-2,20=0,96>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(N_2\): \(3,04-3,04=0< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(NO\): \(3,44-3,04=0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
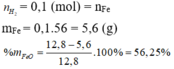
Đáp án A