Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Áp dụng ĐLBT điện tích
0,07 - 2x - 0,1 = 0 =>x=0,015 mol
y + 2z =0,02
trộn X với Y có H+ >< OH- Ba2+ >< SO42-
dd có pH=2 => dd có mt axit => H+ dư OH- hết => \(\left[H^+\right]\)=0,01 => nH+=0,005
H+ + OH- ------> H2O
bđ y 0,1
pư 0,1 <- 0,1
spư y-0,1
=> y - 0,1 = 0,005 => y = 0,105 mol =.> z =
có sai đề k bạn

Bảo toàn điện tích đối với dung dịch X, ta có: 0,07.1 = 0,02.2 + x.1 → x = 0,03
Bảo toàn điện tích đối với dung dịch Y, ta có: y.1 = 0,04.1 → y = 0,04
Khi trộn dung dịch X và Y thì
H+ + OH- → H2O
(0,04) (0,03)
→ nH+còn dư = 0,04 – 0,03 = 0,01 mol → [H+] còn dư = 0,01/0,1 = 0,1M → pH = – lg[H+] = 1
Đáp án C

Đáp án A
Theo ĐL BT ĐT thì x = 0,03 mol
Theo ĐLBT ĐT thì nH+ = nClO4(-)+ nNO3(-) = 0,04 mol
H+ + OH- → H2O
0,04 0,03
nH+ dư = 0,01 mol; [H+] dư = 0,01/0,1 = 0,1 suy ra pH = 1

Đáp án A
Bảo toàn điện tích:
n OH- = x = nNa+ - 2nSO42- = 0,07 – 0,02.2 = 0,03
n H+ = y = n ClO4- + n NO3- = 0,04 > n OH-
n H+ dư = 0,01 mol
⇒ [H+] = 0,01 : 0,1 = 0,1 ⇒ pH = -log10[H+] = 1
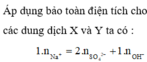


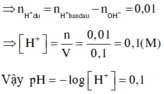
Đáp án C