Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích :
2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O
=> nO = 1 2 nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
Sau đó phản ứng với AgNO3 tạo :
(2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> % V C l 2 X = 53,85%

Đáp án C
Khi tác dụng với HCl chỉ có các oxit bị hòa tan
→ nHCl = 4nO2 → nO2 = 0,03 mol
Gọi số mol của Cl2 và Ag lần lượt là x, y mol
Bảo toàn nguyên tố Cl → nAgCl = 2nCL2 + nHCl = 2. x + 0,12
→ 143,5( 2. x + 0,12) + 108y = 28,345
Bảo toàn electron cho toàn bộ quá trình 3nFe + 2nZn = 2nCl2 + 4nO2 + nAg
→ 3. 0,04 + 2.0,04 = 2.x + 4. 0,03 + y
Giải hệ → x= 0,035 và y = 0,01
![]()

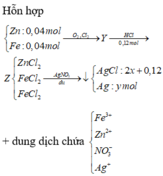
Mol \(Fe\) = 0,11 mol
Mol hh khí= 0,1 mol
BT klg\(\Rightarrow\)m hh khí=12,09-6,16=5,93g
Gọi mol \(Cl_2\) và mol \(O_2\) lần lượt là x và y
\(\Rightarrow\) x+y=0,1 và 71x+32y=5,93
\(\Rightarrow\)x=0,07 và y=0,03
Mol \(Cl-\) trong muối= 0,07.2=0,14 mol = mol \(AgCl\)
\(Fe\) có thể lên \(Fe+2\) và \(Fe+3\) nên
\(Fe\Rightarrow Fe^{+2}+2e\)
a mol. \(\Rightarrow\)2a mol
\(Fe\Rightarrow Fe^{+3}+3e\)
b mol \(\Rightarrow\)3b mol
\(Cl_2+2e\Rightarrow2Cl-\)
0,07 \(\Rightarrow\)0,14 mol
\(O_2+4e\Rightarrow2O_2-\)
0,03\(\Rightarrow\)0,12 mol
Mol e nhường= nhận\(\Rightarrow\)2a+3b=0,26 mol và tổng mol \(Fe\)là a+b=0,11 mol\(\Rightarrow\)a=0,07 và b=0,04
\(Fe^{2+}+Ag^+\Rightarrow Fe^{3+}+Ag\)
0,07 mol \(\Rightarrow\)0,07 mol
Số gam kết tủa = 0,07.108+0,14.143,5=27,65\(\Rightarrow\)chọn A
Đáp án b nhé :44,87...lưu ý khi tính ra số mol fe2+ = 0,07, mol fe3+=0,04 thì =>>> mol Cl- = 0,07x2 + 0,04x3= 0,26 mol.....==>> mol AgCl=0,26.......Để ý hòa tan bằng dd Hcl vừa đủ thì oxit phải chuyển thành hết muối clorua....ko đẻ ý điều này rất dễ nhầm đáp án là A...lừa đó ^^

Đáp án : D
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%

Đáp án : B
Bảo toàn khối lượng
⇒ m C l 2 + m O 2 = 2 , 61
Cl2 : x mol ; O2 : y mol ; Ag:z mol ; AgCl : (2x + 0,03)
ta có 71x + 32y = 2,61
(2x + 0,03).143,5 + 108z =13,995
2x+ 4y + z= 0,02.2 + 0,03.3
=>x = 0,03 ; y = 0,015 ; z = 0,01
=>%VO2 = 0,015.100/(0,015 + 0,03) = 33,33%

Đáp án A
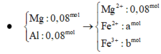
Mol Mg = mol Fe = 0,08 và mol HCl = 0,24
Mg - 2e ---> Mg2+
0,08--0,16
Fe - 3e ---> Fe3+
0,08--0,24
Cl2 + 2e ---> 2 Cl-
a-----2a---------2a
O2 + 4e ---> 2 O2-
b-------4b--------2b
Ag+ + e ---> Ag
x--------x---------x
2 H+ + O2- --> H2O
0,24----0,12
mol O = 2b = 0,12 ==>> b = 0,06
Bảo toàn mol e : 2a + 4b + x = 0,16 + 0,24 = 0,40 ==> 2a + x = 0,16
Kết tủa gồm : AgCl (2a + 0,24) mol và Ag x mol
==> 143,5(2a+0,24) + 108x = 56,69 ==> 287a + 108x = 22,25
===> a = 0,07 và x = 0,02
==> X gồm 0,07 mol Cl2 và 0,06 mol O2 ===> %mol O2 = 46,15




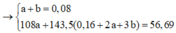
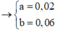
Chọn C
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%