Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)

Đáp án : A
Khi cho Fe vào thấy khối lượng kim loại thu được tăng => Còn Cu2+
+) Catot : Cu2+ + 2e -> Cu
,a -> 2a -> a
+) Anot : 2H2O – 4e -> 4H+ + O2
,2a -> 2a -> 0,5a
=> mgiảm = 4 = mCu pứ + mO2 = 64a + 16a => a = 0,05 mol
Dung Dịch sau điện phân có b mol Cu2+ và 0,1 mol H+
=> mKL sau – mKl trước = mCu – mFe pứ = 64b – 56.( b + 0,1.0,5) = 38,2 – 36,4
=> b = 0,575 mol
=> x = 1,25M

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
\(m_{ddCuSO_4}\) = 25.1,12 = 28g\(\Rightarrow m_{CuSO_4}\) = 4,2g\(\Rightarrow n_{CuSO_4}\) = 0,02625mol
Fe + CuSO4\(\rightarrow\) FeSO4 + Cu
x \(\rightarrow\) x-----------------x---------x
\(m_{tăng}\) = 64x-56x = 0,08g \(\Rightarrow\) x=0,01mol
\(n_{Fe\left(bđ\right)}\) = 5/112 mol \(\Rightarrow\) Fe dư, CuSO4 dư ( vì phản ứng ko hoàn toàn)
\(\Rightarrow\)trong dd sau pứ có \(FeSO_4=0,01mol\); \(CuSO_4=0,01625mol\)
mdd = mCuSO4 + mFepư - mCu = mddCuSO4 - \(m_{giảm}\) =28 - 0,08 = 27,92g
\(\Rightarrow\) C% FeSO4 = 0,01(56 + 96).100/ 27,92 = 5,44%
C% CuSO4 = 0,01625.(64 + 96).100/27,92 = 9,31%

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 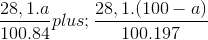 = 0,2
= 0,2
=> a = 29,89.

+khi cho hỗn hợp gồm Fe và 1 oxit sắt + dd HCl, chỉ có Fe pứ tạo khí H2.====> nH2= nFe=\(\frac{0,896}{22,4}\)=0,04 => mFe= 0,04.56=2.24(g)
=> moxit= 16,6-2,24=14,36(g).
+ dd A là muối của sắt hai, vì tác dụng với axit có tính oxh yếu, ===> Fe2+ ( FeCl2)
+ cho A+ NaOH....===> thu được kết tủa Fe(OH)2↓, nung trong không khí thu được chất rắn Fe2O3( 17,6g)
nFe203=0,11( m0)
vì Fecl2 sinh ra do cả sắt và oxit sắt...
các pt phản ứng
Fe+ 2 HCl===> FeCl2 + H2
0,04 0,04
đặt ct của oxit sắt là FexOy.
FexOy+ 2y HCl====> x FeCl2(x/y) + y H20
0,18/x 0,18
2 NaOH + FeCl2======> Fe(OH)2+ 2NaCl.................
KẾT QUẢ TA CÓ... x/y= 2/3====> Fe2O3.
%Fe=13,49(%) và % Fe203=86,51(%)

Đáp án : C
Vì ngâm lá sắt vào dung dịch sau điện phân thấy khối lượng tăng => chứng tỏ Cu2+ còn dư
Catot : Cu2+ + 2e -> Cu
Anot : 2H2O -> 4H+ + O2 + 4e
,nO2 = 0,05 mol
=> 4nO2 = 2nCu2+ đp => nCu2+ đp = 0,1 mol
Fe + 2H+ -> Fe2+ + H2
0,1 <- 0,2 mol
Fe + Cu2+ -> Fe2+ + Cu
,x -> x -> x
=> mtăng = 64x – 56(x + 0,1) = 0,8g
=> x = 0,8 mol
=> nCuSO4 bđ = 0,1 + 0,8 = 0,9 mol
=> CM(CuSO4) = 1,8M