Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
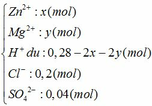
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
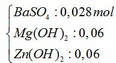
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

Bắt đầu xuất hiện kết tủa nghĩa là: NaOH đầu tiên sẽ trung hòa HCl dư trước
NaOH + HCldư → NaCl + H2O
0,2 ←0,2
→ 2V1 = 0,2 → V1 = 0,1
Đến khi kết tủa không thay đổi khối lượng thì khi đó kết tủa bị hòa tan hết.
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
3x ←x → x
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x ←x
→ 0,2 + 4x = 0,6.2 → x = 0,25
=> y = 0,025
=> m = 17,75g

a/ Xác định kim loại M
nH2SO4 ban đầu = 78,4.6,25:100=0.05 mol
Goi số mol MO là a mol, mMO = (M+16).a
MO+H2SO4---MSO4+H2O(1)
a mol amol amol
Số mol axit dư sau phản ứng (1): 0,05-a mol
mdd sau phản ứng: (m+16)a+78,4
Theo bài ra ta có: 2,433=100.(0,05-a).98/[(m+16)a+78,4] (I)
Mặt khác: MO+CO---M+CO2 (2)
a mol a mol a mol amol
Theo bài ra CO2 tham gia phản ứng hết, các phản ứng có thể xảy ra:
CO2+2NaOH--->Na2CO3+H2O
b 2b b b
CO2+NaOH--->NaHCO3
c c c
Khối lượng muối tạo thành: 100b+84c=2,96
- Nếu NaOH dư không xảy ra phản ứng (3). Tức là c = 0 mol,
b = a = 2,96 : 106 = 0,028 mol. Thay a = 0,028 vào (I) ta tìm được M = 348,8 (loại).
- Nếu NaOH phản ứng hết: 2b + c = 0,5 . 0,1 = 0,05 (III)
Từ (II) và (III) ta có : 106 b + 84(0,05 – 2b) = 2,96
62b = 1,24 suy ra: b= 0,02 và c = 0,01
Theo 2, 3 và 4, n co2 = 0,03= n MO = a = 0,03.
Thay giá trị a = 0,03 và (I) ta có: 0,07299M = 4,085
M = 56 vậy kim loại M là Fe, mMO=(56+16).0,03= 2,16 g
b/ Dung dịch E gồm FeSO4 0,03 mol và H2SO4 dư 0,02 mol. Khi cho Al phản ứng hoàn toàn tạo 1,12 gam chất rắn, H2SO4 phản ứng hết.
2Al+3H2SO4---->Al2(SO4)3+3H2
2Al+3FeSO4----->Al2(SO4)3+3Fe
Khối lượng Fe trong dung dịch E : 56 . 0,03 = 1,68 gam > 1,12 gam
Như vậy FeSO4 còn dư thì Al tan hết. Vây t = 1,12: 56 =0,02 mol
Vây n Al = 0,04 : 3 + 0,04:3 = (0,08 : 3) mol
Vây khối lượng x = 0,08: 3 . 27 = 0,72 gam

Cho hỗn hợp X vào dung dịch HCl lấy dư:
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2
Dung dịch Y gồm: AlCl3, MgCl2, FeCl2, HCl dư
Khí Z là H2
Chất rắn A là Cu
Cho A tác dụng với H2SO4 đặc nóng.
PTHH: Cu + 2H2SO4(đặc, nóng) → CuSO4 + SO2 + 2H2O
Khí B là SO2
Cho B vào nước vôi trong lấy dư
PTHH: SO2 + Ca(OH)2 → CaSO3 + H2O
Kết tủa D là CaSO3
Cho dung dịch NaOH vào Y tới khi kết tủa lớn nhất thì dừng lại.
PTHH: NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Chất rắn E là: Al(OH)3, Mg(OH)2, Fe(OH)2
Nung E trong không khí
Chất rắn G là Al2O3, MgO, Fe2O3

Fe3O4+4CO=>3Fe+ 4CO2
CuO+CO=>Cu+CO2
Cr B gồm Fe Cu
HH khí D gồm CO dư và CO2
CO2 +Ca(OH)2=>CaCO3+H2O
p/100 mol<= p/100 mol
2CO2+Ca(OH)2 => Ca(HCO3)2
p/50 mol
Ca(HCO3)2+ 2NaOH=>CaCO3+ Na2CO3+2H2O
p/100 mol p/100 mol
Tổng nCO2=0,03p mol=nCO
=>BT klg
=>m+mCO=mCO2+mB=>mB=m+0,84p-1,32p=m-0,48p
c) hh B Fe+Cu
TH1: Fe hết Cu chưa pứ cr E gồm Ag Cu
dd Z gồm Fe(NO3)2
Fe+2Ag+ =>Fe2+ +2Ag
TH2:Cu pứ 1p cr E gồm Cu và Ag
Fe+2Ag+ => Fe2+ +2Ag
Cu+2Ag+ =>Cu2+ +2Ag
Dd Z gồm 2 muối của Fe2+ và Cu2+

nHCl = 0,1. 0,8 = 0,08 (mol) ; nAl2(SO4)3 = 0,1.0,5 = 0,05 (mol) => nAl3+ = 0,1 (mol); nSO42- = 0,15 (mol)
Gọi số mol Ba là x (mol)
Ba + 2HCl → BaCl2 + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
3BaCl2 + Al2(SO4)3 → 3BaSO4 ↓+ 2AlCl3
3Ba(OH)2 + Al2(SO4)3 → BaSO4↓ + 2Al(OH)3↓
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Vì dd X + HCl sinh ra 0,78 gam kết tủa Al(OH)3 : 0,1 (mol) nên trong dung dịch X chắc chắn có chứa Ba(AlO2)2 => lượng OH- sinh ra đã hòa tan 1 phần lượng kết tủa Al(OH)3
Ba + 2H+ → Ba2+ + H2↑
0,04 ← 0,08 (mol)
Ba + 2H2O → Ba2+ + 2OH- + H2↑
(x – 0,04 ) → (2x – 0,08) (mol)
Ba2+ + SO42- → BaSO4
3OH- + Al3+ → Al(OH)3↓
OH- + Al(OH)3 → AlO2- + 2H2O
Vì Al(OH)3 bị hòa tan 1 phần
=> nOH - > 3nAl3+
=> 2x – 0,08 > 3. 0,1
=> x > 0,19
=> nBa2+ > 0,19 (mol) => SO42- bị kết tủa hết => nBaSO4 = nSO42- = 0,15 (mol)
Mặt khác: nOH- = 4nAl3+ - nAl(OH)3 còn lại => nAl(OH)3 còn lại = 0,48 – 2x (mol)
=> nAl(OH)3 còn lại = 0,32 – 2x (mol)
mdd giảm = mBaSO4 + mAl(OH)3 còn lại + mH2 - mBa
=> 0,15.233 + (0,48 – 2x).78 + 2x - 137x = 14,19
=> 291x = 58,2
=> x = 0,2 (mol)
=> mBa = 0,2. 137 = 27,4 (g)
Vậy dung dịch X chứa:
TH1: AlO2- dư, H+ hết
AlO2- + H+ + H2O → Al(OH)3↓
=> nH+ = nAl(OH)3 = 0,01 (mol) => VHCl = n: CM = 0,01 (lít) = 10 (ml)
TH2: AlO2- , H+ đều phản ứng hết, kết tủa sinh ra bị hòa tan 1 phần
AlO2- + H+ + H2O → Al(OH)3↓
0,02 → 0,02 → 0,02 (mol)
H+ + Al(OH)3 → Al3+ + 2H2O
0,01← (0,02 – 0,01) (mol)
=> nH+ = 0,02 + 0,01 = 0,03 (mol) => VHCl = n : CM = 0,03 (lít) = 30 (ml)
nHCl = 0,1. 0,8 = 0,08 (mol) ; nAl2(SO4)3 = 0,1.0,5 = 0,05 (mol) => nAl3+ = 0,1 (mol); nSO42- = 0,15 (mol)
Gọi số mol Ba là x (mol)
Ba + 2HCl → BaCl2 + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
3BaCl2 + Al2(SO4)3 → 3BaSO4 ↓+ 2AlCl3
3Ba(OH)2 + Al2(SO4)3 → BaSO4↓ + 2Al(OH)3↓
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Vì dd X + HCl sinh ra 0,78 gam kết tủa Al(OH)3 : 0,1 (mol) nên trong dung dịch X chắc chắn có chứa Ba(AlO2)2 => lượng OH- sinh ra đã hòa tan 1 phần lượng kết tủa Al(OH)3
Ba + 2H+ → Ba2+ + H2↑
0,04 ← 0,08 (mol)
Ba + 2H2O → Ba2+ + 2OH- + H2↑
(x – 0,04 ) → (2x – 0,08) (mol)
Ba2+ + SO42- → BaSO4
3OH- + Al3+ → Al(OH)3↓
OH- + Al(OH)3 → AlO2- + 2H2O
Vì Al(OH)3 bị hòa tan 1 phần
=> nOH - > 3nAl3+
=> 2x – 0,08 > 3. 0,1
=> x > 0,19
=> nBa2+ > 0,19 (mol) => SO42- bị kết tủa hết => nBaSO4 = nSO42- = 0,15 (mol)
Mặt khác: nOH- = 4nAl3+ - nAl(OH)3 còn lại => nAl(OH)3 còn lại = 0,48 – 2x (mol)
=> nAl(OH)3 còn lại = 0,32 – 2x (mol)
mdd giảm = mBaSO4 + mAl(OH)3 còn lại + mH2 - mBa
=> 0,15.233 + (0,48 – 2x).78 + 2x - 137x = 14,19
=> 291x = 58,2
=> x = 0,2 (mol)
=> mBa = 0,2. 137 = 27,4 (g)
Vậy dung dịch X chứa:
+ V ml HCl 1M→ Al(OH)3: 0,01 (mol)
TH1: AlO2- dư, H+ hết
AlO2- + H+ + H2O → Al(OH)3↓
=> nH+ = nAl(OH)3 = 0,01 (mol) => VHCl = n: CM = 0,01 (lít) = 10 (ml)
TH2: AlO2- , H+ đều phản ứng hết, kết tủa sinh ra bị hòa tan 1 phần
AlO2- + H+ + H2O → Al(OH)3↓
0,02 → 0,02 → 0,02 (mol)
H+ + Al(OH)3 → Al3+ + 2H2O
0,01← (0,02 – 0,01) (mol)
=> nH+ = 0,02 + 0,01 = 0,03 (mol) => VHCl = n : CM = 0,03 (lít) = 30 (ml)