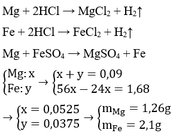Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Mg + H2SO4 \(\rightarrow\)MgSO4 + H2 (1)
Fe + H2SO4 \(\rightarrow\)FeSO4 + H2 (2)
Mg + FeSO4 \(\rightarrow\)MgSO4 + Fe (3)
nH2=\(\dfrac{2,016}{22,4}=0,09\left(mol\right)\)\
Đặt nMg=a
nFe(2)=b
nFe(3)=nMg=a
Ta có:a+b=0,09
mFe(3)-mMg=1,68
56a-24a=1,68
32a=1,68
a=0,0525
b=0,0375
mMg=24.0,0525=1,26(g)
mFe(2)=56.0,0375=2,1(g)

Ta có phương trình phản ứng :
Mg + H2SO4 \(\rightarrow\) MgSO4 + H2\(\) ( 1 )
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2\(\) ( 2 )
Mg + FeSO4 \(\rightarrow\) MgSO4 + Fe ( 3 )
\(n_{H_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)\(\)
Đặt số mol của Mg và Fe lần lượt là a và b . ( a , b > 0 ) \(n_{Fe\left(3\right)}=n_{Mg}=a\) Ta có : \(\left\{{}\begin{matrix}a+b=0,09\\m_{Fe\left(3\right)}-m_{Mg}=1,68\Rightarrow56a-24a=1,68\Rightarrow32a=1,68\Rightarrow a=0,0525\end{matrix}\right.\) \(\Rightarrow b=0,09-0,0525=0,0375\) \(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=24.0,0525=1,26\\m_{Fe\left(3\right)}=56.0,0375=2,1\end{matrix}\right.\)PT1: Mg + H2SO4 -> MgSO4 +H2\(\uparrow\)
PT2: Fe + H2SO4 -> FeSO4 +H2\(\uparrow\)
theo 2 pt trên khí đó là H2
=> nH2=V/22,4=2,016/22,4=0,09(mol)
Cho hỗn hợp 2 kim loại tác dụng với FeSO4 thì chỉ có Mg phản ứng ,
Gọi a là số mol Mg
Pt3: Mg +FeSO4 -> MgSO4 + Fe\(\downarrow\)
vì sau phản ứng 3 thì khối lượng kim loại kim loại tăng 1,68 gam nên
mFe(3) - mMg(3)=1,68
<=> 56a-24a=1,68
=> a= 0,0525 (mol)
=> nMg=0,0525(mol)
Theo pt 1: nMg=nH2=0,0525(mol)
=> nH2(còn lại ở PT2)=0,09-0,0525=0,0375(mol)
mà nH2(pt2)=nFe
=> nH2(pt2)=nFe =0,0375(mol)
Vậy mMg=nMg.MMg=0,0525.24=1,26(g)
mFe=nFe.MFe=0,0375.56=2,1 (g)

Đặt số mol Al, Fe, Mg trong 15,8 g hh là x, y, z
pt khối lượng: 27x + 56y+ 24z = 15,8
pt bảo toàn electron: 3x+ 2y+ 2z = 2*nH2
Đặt số mol Al, Fe, Mg trong 0,15 mol lúc sau là kx, ky, kz
(tỉ lệ số mol giữa các chất không đổi)
pt số mol: k(x + y + z) = 0,15 (1)
pt bảo toàn e: k(3x + 3x + 2y) = 3nNO (2)
lấy (1) chia (2) được pt thứ 3, giải 3 pt 3 ẩn là xong :D

nH2=0.56:22,4=0,025 mol
Fe+H2SO4----->FeSO4+H2
2AL+3H2SO4----->AL2(SO4)3 +3H2
Gọi x,y làn lượt là số mol Fe và AL
ta có hệ pt
\(\begin{cases}56x+27y=0,83\\x+1,5y=0,025\end{cases}\)
\(\begin{cases}x=0,01mol\\y=0,01mol\end{cases}\)
mFe=0,01.56=0,56 g
mAl=0,83-0,56=0,27 g
%mFe=(0,56:0,83).100=67,47%
%mAl=100-67,47=32,53%

Số mol khí H2 = 0,56: 22,4 = 0,025 mol.
Gọi X, у là số mol của Al, Fe.
Phương trình hóa học:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
p.ư : x l,5x (mol)
Fe + H2SO4 -> FeSO4 + H2
y —> y (mol)
Theo khối lượng hỗn hợp và mol H2 ta có hệ phương trình:
Giải ra ta có: x = y = 0,01 = nAl = nFe
%Al = .100% = 32,53% ; %Fe = 100 - 32,53 = 67,47%
Gọi x, у là số mol của Al, Fe =>27x + 56y = 0,83 gam (*)
PTHH 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (1)
(mol) x l,5x
Fe + H2SO4 → FeSO4 + H2 (2)
(mol) y y
Từ phương trình hóa học (1) và (2) ta có
nH2 = 0,56/22,4 = 0,025 = 1,5x + y (**)
Từ (*) và (**) =>x = y = 0,01 = nAl = nFe
Phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
%Al = (0,01.27 / 0,83) . 100% = 32,53% ;
%Fe = 100 - 32,53 = 67,47%