Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 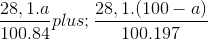 = 0,2
= 0,2
=> a = 29,89.

Ta có : λo = 2300Ǻ = 2,3.10-7 (m). h= 6,625.10-34 (J.s), c = 3.108 m/s.
Emax=1,5( eV) = 1,5.1,6.10-19= 2,4.10-19(J)
Mặt khác: Theo định luật bảo toàn năng lượng và hiện tượng quang điện ta có công thức
(h.c)/ λ = (h.c)/ λo + Emax suy ra: λ=((h.c)/( (h.c)/ λo + Emax)) (1)
trong đó: λo : giới hạn quang điện của kim loại
λ: bước sóng của ánh sáng chiếu vào bề mặt kim loại để bứt electron ra khỏi bề mặt kimloại.
Emax: động năng ban đầu ( năng lượng của ánh sáng chiếu vào bề mặt kim loại).
Thay số vào (1) ta có:
λ = ((6,625.10-34.3.108)/((6,625.10-34.3.108)/(2,3.10-7) + (2,4.10-19)) = 1,8.10-7(m)
= 1800 Ǻ
Thầy xem hộ em lời giải của bài này ạ, em trình bày chưa được rõ ràng mong thầy sửa lỗi cho em ạ. em cám ơn thầy ạ!
Năng lượng cần thiết để làm bật e ra khỏi kim loại Vonfram là:
E===5,4eV
Để electron bật ra khỏi kim loại thì ánh sáng chiếu vào phải có bước sóng ngắn hơn bước sóngtấm kim loại. Mà năng lượng ánh chiếu vào kim loại có E1<E nên electron không thể bật ra ngoài

Mg + HCl - MgCl2 + H2
Al + HCl - AlCl3 + H2
còn Cu đứng sau H nên không phản ứng với HCl.
nCuO = \(\dfrac{16}{80}=0,2\) mol
Pt: 2Cu + O2 --to--> 2CuO
0,2 mol<--------------0,2 mol
.....Mg + 2HCl --> MgCl2 + H2
0,2 mol<-----------0,2 mol
.....2Al + 6HCl --> 2AlCl3 + 3H2
....MgCl2 + 2NaOH --> Mg(OH)2 + 2NaCl
...0,2 mol<---------------0,2 mol
....AlCl3 + 3NaOH --> Al(OH)3 + 3NaCl
....Al(OH)3 + NaOH --> NaAlO2 + 2H2O
..........................................(tan)
...Mg(OH)2 --to--> MgO + H2O
0,2 mol<------------ 0,2 mol
nMgO = \(\dfrac{8}{40}=0,2\) mol
mCu = 0,2 . 64 = 12,8 (g)
mMg = 0,2 . 24 = 4,8 (g)
mAl = mhh - mCu - mMg = 20 - 12,8 - 4,8 = 2,4 (g)
% mCu = \(\dfrac{12,8}{20}.100\%=64\%\)
% mMg = \(\dfrac{4,8}{20}.100\%=24\%\)
% mAl = \(\dfrac{2,4}{20}.100\%=12\%\)

- Từ dung dịch AgNO3 có 3 cách để điều chế Ag:
+ Dùng kim loại có tính khử mạnh hơn để khử ion Ag+.
Cu + 2 AgNO3 → Cu(NO3)2 + 2Ag
+ Điện phân dung dịch AgNO3:
4AgNO3 + 2H2O 4Ag + O2 + 4HNO3
+ Cô cạn dung dịch rồi nhiệt phân AgNO3:
2AgNO3 2Ag + 2NO2 + O2
- Từ dung dịch MgCl2 điều chế Mg: chỉ có một cách là cô cạn dung dịch để lấy MgCl2 khan rồi điện phân nóng chảy:
MgCl2 Mg + Cl2.
\(4AgNO_3+2H_2O\) \(\underrightarrow{dpdd}\) \(4Ag+O_2\uparrow+4HNO_3\)
\(2AgNO_3\) \(\underrightarrow{t^o}\) \(2Ag+2NO_2+O_2\)
\(MgCl_2\) \(\underrightarrow{dpnc}\) \(Mg+Cl_2\)

Các cặp chất là đổng đẳng của nhau : C3H7OH và C4H9OH;
CH3 - О - C2H5 và C2H3 - О - C2H5
Các cặp chất là đồng phân của nhau : CH3-O-C2H5 và C3H7OH;
C2H5-O-C2H5 và C4H9OH.

Mol \(Fe_2O_3\) bđ=16/160=0,1 mol

Bài giải:
- Vì =
=>
=
, suy ra polime đó là polietilen (-CH2 – CH2 - )n.
- Không thể là tinh bột (-C6H10O5-)n, vì có tỉ lệ =
, cũng không thể là PVC vì chất này khi cháy phải có sinh ra hợp chất chứa clo.
Đáp án C
Các mệnh đề:
(a) Sai ví dụ Au, Ag không phản ứng với oxi.
(b) Sai vì chỉ có thể điều chế bằng phương pháp điện phân nóng chảy Al2O3.
(c) Đúng vì gang là hợp kim của Fe và C; không khí ẩm là dung môi chất điện li.
(d) Đúng.
(e) Sai ví dụ như Cs rất mềm.
(g) Sai vì Na phản ứng với H2O trước nên thu được Fe(OH)2.