Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Na + Cl2 \(\underrightarrow{t}\) 2NaCl
2NaCl + 2H2O \(\underrightarrow{đpmn}\) 2NaOH + Cl2 + H2
Cl2 + 2NaBr ➝ 2NaCl + Br2
Br2 + 2NaI ➝ 2NaBr + I2
3I2 + 2Al \(\underrightarrow{t}\) 2AlI3
\(Cl_2\) + 2Na => 2NaCl (Điều kiện: nhiệt độ)
2NaCl + \(2H_2O\) => \(Cl_2\) + \(H_2\) + NaOH (Điều kiên: điện phân dung dịch có màng ngăn
\(Cl_2\) + 2NaBr => 2NaCl + \(Br_2\)
\(Br_2\) +2NaI => 2NaBr + \(I_2\)
3\(I_2\) + 2Al => 2\(AlI_3\) (Điều kiện: nhiệt độ, xúc tác: \(H_2O\))

Cho các phản ứng sau :
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng nào không phải là phản ứng oxi hoá - khử ?
Cho các phản ứng sau :
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng A không phải là phản ứng oxi hoá - khử
Vì trong A các nguyên tố không thay đổi số oxh trước và sau phản ứng!!

a. (1) 2KClO3 \(\underrightarrow{t}\) 3O2 + 2KCl
(2) 5O2 + 4P → 2P2O5
(3) P2O5 + H2O → 2H3PO4
b. (1) BaCO3 → BaO + CO2
(2) BaO + H2O → Ba(OH)2

Gợi Ý nhé:
Đối với loại toán này ta nên tìm cách tổ hợp từ các quá trình đã cho để loại đi các chất trung gian và được phương trình cần tính nhiệt phản ứng.
Từ các dữ kiện của bài toán ta có:
CO(NH2)2 (r) + 2HCl (k) \(\rightarrow\) COCl2 (k) + 2NH3 (k) - \(\Delta\)H3 = + 201,0 kJ
COCl2 (k) \(\rightarrow\) CO (k) + Cl2 (k) - \(\Delta\)H2 = + 112,5 kJ
CO (k) + H2O(h) \(\rightarrow\) CO2 (k) + H2 (k) \(\Delta\)H1 = - 41,3 kJ
H2O (l) \(\rightarrow\) H2O (h) \(\Delta\)H5 = 44,01 kJ
H2 (k) + Cl2 (k) \(\rightarrow\) 2HCl (k) 2. \(\Delta\)H4 = 2.(- 92,3) = - 184,6 kJ
Cộng theo từng vế các quá trình trên và loại đi các chất trung gian, ta thu được phương trình: CO(NH2)2 (r) + H2O (l) \(\rightarrow\) CO2 (k) + 2NH3 (k) có nhiệt của phản ứng là DH = (- \(\Delta\)3) + (- \(\Delta\)H2) + \(\Delta\)H1 + \(\Delta\)H5 + 2. \(\Delta\)H4. Thay số có \(\Delta\)H = 131,61 kJ.

a/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(3Cl_2+2Fe\underrightarrow{^{to}}2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_3\)
\(2NaCl+H_2SO_4\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(HCl+CuO\rightarrow CuCl_2+H_2O\)
\(CuCl_2+AgNO_3\rightarrow AgCl+Cu\left(NO_3\right)2\)
b/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2Na\underrightarrow{^{to}}2NaCl\)
\(2NaCl+H_2SO_{4_{dac}}\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(2HCl+Fe\rightarrow FeCl_2+H_2\)
c/
\(MnO_2+4HCl_đ\underrightarrow{^{to}}MnO_2+Cl_2+2H_2O\)
\(Cl_2+2K\underrightarrow{^{to}}2KCl\)
\(2KCl+H_2SO_4\underrightarrow{^{to}}K_2SO_4+2HCl\)
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Br_2+2NaI\rightarrow NaBr+I_2\)
d/
\(2KMnO_4+16HCl_đ\underrightarrow{^{to}}2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(Cl_2+H_2\underrightarrow{^{as}}2HCl\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(FeCl_3+3AgNO_3\rightarrow3AgCl+Fe\left(NO_3\right)_3\)

Những phản ứng sau là phản ứng oxi hóa khử:
.jpg)
.png)
Cl2 vừa là chất khử vừa là chất oxi hóa.
b) .png) + 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
+ 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
CaOCl2: phân tử tự oxi hóa khử, HCl đóng vai trò môi trường
.jpg)
.png) Cl2 vừa là chất oxi hóa, vừa là chất khử.
Cl2 vừa là chất oxi hóa, vừa là chất khử.
.jpg)
.png)
HCl là chất khử, KClO3 là chất oxi hóa
.jpg)

CaOCl2: phân tử tự oxi hóa

\(Br_2+2KOH\rightarrow KBr+KBrO+H_2O\)
\(3Br_2+6KOH\rightarrow5KBr+KBrO+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
\(Br_2+2NaI\rightarrow2NaBr+I_2\)
\(Br_2+2KI\rightarrow2KBr+I_2\)
\(Cl_2+2NaOH\rightarrow KBr+KBrO+H_2O\)
\(3Cl_2+6KOH\rightarrow5KCl+KClO+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
\(Cl_2+2KBr\rightarrow2KCl+Br_2\)
Tương tự cho NaBr, NaI, KI, MgBr2, CaBr2, BaBr2
\(I_2+2KOH\rightarrow KI+KIO+H_2O\)
\(3I_2+6KOH\rightarrow5KI+KIO_3+3H_2O\)
Tương tự cho NaOH và Ca(OH)2
I2 + NaOH ở điều kiện thường hay nhiệt độ thì sản phẩm luôn là muối IO3- nha em

Các phản ứng oxi hóa – khử là: a; b; c và d.
a)
* Fe2O3 + CO \(\underrightarrow{t^o}\) FeO + CO2
Bước 1:
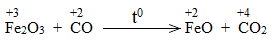
Bước 2:
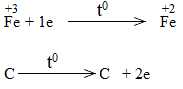
Bước 3:
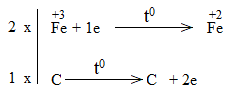
Bước 4:
Fe2O3 + CO \(\underrightarrow{t^o}\) 2FeO + CO2
Fe2O3 là chất oxi hóa.
CO là chất khử.
* FeO + CO \(\underrightarrow{t^o}\) Fe + CO2
Bước 1:
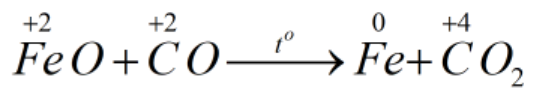
Bước 2:
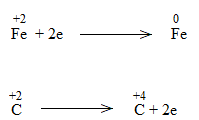
Bước 3:
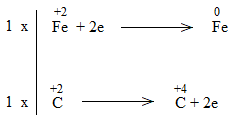
Bước 4:
FeO + CO \(\underrightarrow{t^o}\) Fe + CO2
FeO là chất oxi hóa.
CO là chất khử.
b)
* ZnS + O2 \(\underrightarrow{t^o}\) ZnO + SO2
Bước 1:
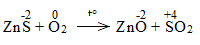
Bước 2:
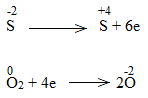
Bước 3:
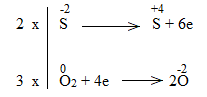
Bước 4:
2ZnS + 3O2 \(\underrightarrow{t^o}\) 2ZnO + 2SO2
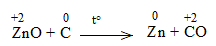
* ZnO + C \(\underrightarrow{t^o}\) Zn + CO
Bước 1:
Bước 2:
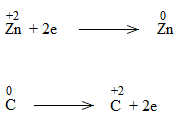
Bước 3:
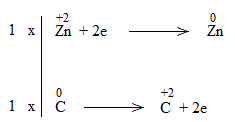
Bước 4:
ZnO + C to\(\underrightarrow{t^o}\) Zn + CO
ZnS là chất khử.
O2 là chất oxi hóa
c)
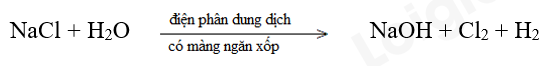
Bước 1:
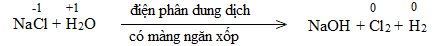
Bước 2:
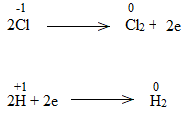
Bước 3:
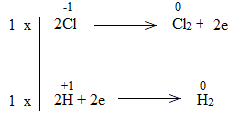
Bước 4:

NaCl là chất khử.
H2O là chất oxi hóa.
d) C2H5OH + O2 \(\underrightarrow{t^o}\) CO2 + H2O
Bước 1:
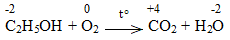
Bước 2:
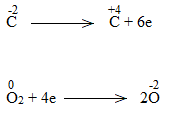
Bước 3:
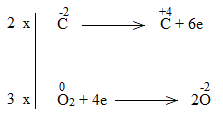
Bước 4:
C2H5OH + 9/2O2 \(\underrightarrow{t^o}\) 2CO2 + 6H2O
C2H5OH là chất khử.
O2 là chất oxi hóa.

Chọn đáp án D
C l 2 + 2NaBr → 2NaCl + B r 2
C l 2 có thể oxi hóa được B r - thành B r 2 → tính oxi hóa của C l 2 mạnh hơn B r 2 .