Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(Mg+2H_2SO_4\rightarrow2MgSO_4+SO_2+H_2\)
________x________________________________x
PTHH: \(Cu+2H_2SO_4\rightarrow2CuSO_4+SO_2+H_2\)
_______y_________________________________y
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+64y=11,2\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\%Mg=\dfrac{0,2.24}{11,2}.100\%\simeq42,85\%\)
\(\Rightarrow\%Cu=100\%-42,85\%=57,15\%\)

nBr2=0,05 mol
SO2 + Br2 + H2O =>H2SO4 +2HBr
0,05 mol<=0,05 mol
Chỉ có Cu pứ vs H2SO4 đặc nguội
Cu =>Cu+2 +2e
0,05 mol<= 0,1 mol
S+6 +2e =>S+4
0,1 mol<=0,05 mol
=>nCu=0,05 mol=>mCu=3,2g
=>mAl=5,9-3,2=2,7g
=>nAl=0,1 mol
Tổng nhh cr=0,1+0,05=0,15 mol

1,\(n_{hhB}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(d_{\frac{hhB}{H_2}}=\frac{\overline{M}}{2}=8\Rightarrow\overline{M}=16\)
ta có sơ đồ dường chéo:
H 2 NO = 2 30 16 14 14
=>\(\frac{n_{H_2}}{n_{NO}}=1\Rightarrow n_{H_2}=n_{NO}=0,25\left(mol\right)\)
ta có các quá trình nhường nhận e:
\(Mg^0\rightarrow Mg^{+2}+2e\) \(Al^0\rightarrow Al^{+3}+3e\)
\(N^{+5}+3e\rightarrow N^{+2}\) \(2H^{+1}+2e\rightarrow H_2^0\)
0,25................0,25 0,25
mNO3=0,25.62=15,5(g)
mSO4=0,25.96=24(g)
=>mmuối=mkl+mNO3+mSO4=8,5+15,5+24=48(g)

nFe = 0,24 (mol)
*TH1: H2SO4 đặc còn dư sau phản ứng
2Fe + 6H2SO4 (đặc) -t\(^o\)-> Fe2(SO4)3 + 3SO2 + 6H2O (1)
0,24..............................................0,12
Theo (1) nFe2(SO4)3 = 0,12 (mol)
=> m muối = 0,12 . 400 = 48 (g) > 42,24 (g)
=> Loại
*TH2: H2SO4 tác dụng hết, Fe còn dư sau phản ứng với H2SO4.
Gọi a, b lần lượt là số mol của Fe pứ ở phương trình (2) và (3)
2Fe + 6H2SO4 (đặc) -t\(^o\)-> Fe2(SO4)3 + 3SO2 + 6H2O (2)
a..........3a...................................0,5a.............1,5a
Fe + Fe2(SO4)3 ---> 3FeSO4 (3)
b......................................3b
Ta có: a + b = 0,24 (I)
0,5a.400 + 3b.152 = 42,24 (II)
Từ (I) và (II) ta được: b < 0 (loai)
Chịu :V Chỉ là lúc đầu định hình ra cách giải, nhưng nghiệm thế này thì khó
Bài này ra 2 muối sắt cơ. Là FeSO4 và Fe2(SO4)3
Do H2SO4 đặc hết, Fe dư nên xẩy ra pứ
Fe + Fe2(SO4)3 \(\rightarrow\)3FeSO4

\(a.2Fe+6H_2SO_{4\left(đặc\right)}\rightarrow\left(t^o\right)Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\\ n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{Fe}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15}{3}=0,05\left(mol\right)\\ a,m=m_{Fe}=0,1.56=5,6\left(g\right)\\ b,m_{Fe_2\left(SO_4\right)_3}=400.0,05=20\left(g\right)\)

a, nSO2 = 0,315 mol
Cu +2 H2SO4 \(\rightarrow\) CuSO4 + SO2 + 2H2O
x \(\rightarrow2x\) \(\rightarrow\) x mol
2Al + 6H2SO4 \(\rightarrow\) Al2SO4+ 3SO2 + H2O
y \(\rightarrow3y\) \(\rightarrow\) \(\dfrac{3}{2}\)y mol
ta có hệ pt ;
\(\left\{{}\begin{matrix}64x+27y=11,19\\x+\dfrac{3}{2}y=0,315\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,12\\y=0,13\end{matrix}\right.\)
mCu = 0,12 . 64 =7,68 g
% mCu= \(\dfrac{7,68}{11,19}.100\%=68,63\%\)
\(\Rightarrow m_{Al}=31,37\%\)
b, n H2SO4= 2x+ 3y= 2. 0,12 + 3.0,13=0,63 mol
\(\Rightarrow m_{H2SO4}=0,63.98=61,74g\)
C% h2so4 = \(\dfrac{61,74}{63}.100\%\) = 98%
c, nBr (đb)= 0,2 . 1,5=0,3 mol
SO2+ Br2+ 2H2O \(\rightarrow2HBr+H_2SO_4\)
0,315 \(\rightarrow\) 0,315
0,3
0,015 \(\Rightarrow Br_{dư}\)
suy ra SO2 k đủ để làm mất màu dd brom

nCu= x mol; nAg= y mol
Cu + 2H2SO4→ CuSO4 + SO2↑ + H2O (1)
2Ag + 2H2SO4→ Ag2SO4 + SO2↑ + 2H2O (2)
SO2(k) + Br2 + 2H2O → H2SO4 + 2HBr (3)
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (4)
Theo PTPU (4), ta có: n↓= nBaSO4= nH2SO4 (4)= 0,08 mol
Theo PTPU (3), ta có: nSO2= nH2SO4 (4)= 0,08 mol
Theo PTPU (1) và (2), ta có: nSO2= nCu + 2nAg = x + 0,5y = 0,08 mol (5)
Tổng khối lượng hỗn hợp ban đầu: mhỗn hợp= mCu + mAg = 64x + 108y = 11,2 (6)
Giải hệ hai phương trình (5) và (6) ta được: x= 0,04 ; y= 0,08
→mCu= 0,04x64= 2,56 (g) →%mCu=2,56/11,2x100% = 22,86%
→%mAg= 100% - %mCu= 77,14%
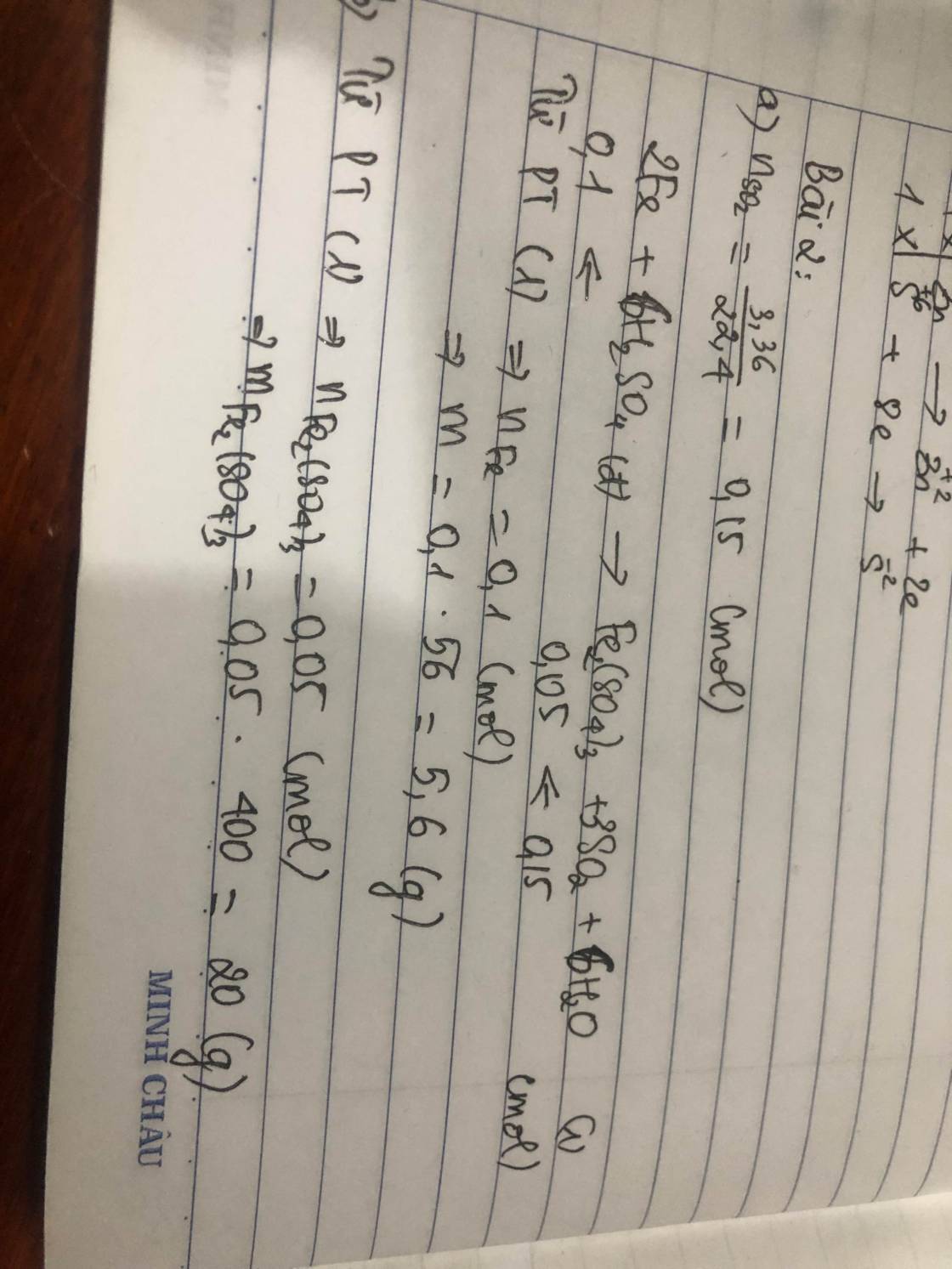

Đáp án A
Số mol SO2 thu được là: n SO 2 = 5 , 6 22 , 4 = 0 , 25 mol