Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.
a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Đáp án C
Khi cho dung dịch FeSO4 vào trong hỗn hợp Zn và HCl thì xảy ra thêm phản ứng
Zn + Fe2+à Fe + Zn2+
Phản ứng này tạo ra lớp sắt bám trên bề mặt kẽm làm xảy ra hiện tượng ăn mòn điện hóa và vì vậy khiến kẽm bị ăn mòn mạnh hơn.

Đáp án B
Lúc đầu chỉ xảy ra ăn mòn hóa học giữa Fe và HCl.
Khi thêm vài giọt CuSO4 vào thì xảy ra thêm phương trình: Fe + Cu2+ → Fe2+ + Cu
Cặp Fe-Cu xảy ra ăn mòn điện hóa làm cho khí thoát ra nhanh và nhiều hơn => Chọn B.

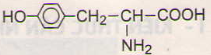 với các chất sau:
với các chất sau:
Đáp án B
Lúc đầu chỉ xảy ra ăn mòn hóa học giữa Fe và HCl.
Khi thêm vài giọt CuSO4 vào thì xảy ra thêm phương trình: Fe + Cu2+ → Fe2+ + Cu
Cặp Fe-Cu xảy ra ăn mòn điện hóa làm cho khí thoát ra nhanh và nhiều hơn