Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = 0,1 mol; nS = 0,05 mol
a) Phương trình phản ứng:
Fe + S → FeS (1)
nFe dư = 0,1 – 0,05 = 0,05 nên hỗn hợp chất rắn A có Fe và FeS.
Fe + 2HCl → FeCl2 + H2↑ (2)
FeS + 2HCl → FeCl2 + H2S↑ (3)
b) Dựa vào phương trình phản ứng (2) và (3), ta có:
nHCl= 0,1 + 0,1 = 0,2 mol
VHCl = 0,2 /1 = 0,2 lít.

PTHH:
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
Đặt \(\hept{\begin{cases}x\left(mol\right)=n_{MgO}\\y\left(mol\right)=n_{Al_2O_3}\end{cases}}\)
\(\rightarrow n_{MgCl_2}=x\) và \(n_{AlCl_3}=2y\)
\(\rightarrow\hept{\begin{cases}40x+102y=12,2\\95x+133,5.2y=31,45\end{cases}}\)
\(\rightarrow\hept{\begin{cases}x=0,05mol\\y=0,1mol\end{cases}}\)
Theo phương trình: \(n_{HCl}=n_{NaOH}=0,02.2=0,04mol\)
\(\rightarrow\text{Σ}n_{HCl}=2x+6y+0,04=0,1+0,6+0,04=0,74mol\)
\(\rightarrow m_{HCl\left(bđ\right)}=0,74.36,5=27,01g\)

Khi cho A vào H2O và khi cho A vào NaOH thể tích khí thoát ra khác ở TN1 bé hơn chứng tỏ trong TN1 Al dư, vậy nH2 = 0,04 mol = 4nBa => nBa = 0,01 mol
Ba + H2O ------> Ba(OH)2 + H2
Al + OH- + H2O -----> AlO2- + 3/2 H2
nOH- = 2nBa
nH2 = nBa + 3/2.2nBa = 4nBa
nH2 ở TN2 = 0,31 mol = nBa + 3/2 nAl ( Vì OH- dư)
=> nAl = 0,2 mol
nH2 ở TN3 = 0,41 mol = nBa + 3/2nAl + nMg
=> nMg = 0,1 mol
Al + 3HCl -----> AlCl3 + 3/2H2
Mg + HCl -------> MgCl2 + H2
1. m = 21,5 gam
%Ba = 0,1.137/ 21,5.100 = 63,72%
%Al = 0,2.27/ 21,5.100 = 25,12%
%Mg = 100 -25,12 - 63,62 = 11,16%

Vì Cu là kim loại đứng sau Mg nên Cu k t/d vs axit
PTHH: Zn + H2SO4 → ZnSO4 + H2↑
Số mol của hiđrô là: 2,24 : 22,4 = 0,1 (mol)
Số mol của Zn là: 0,1 . 1 = 0,1(mol)
Khối lượng của Zn là: 0,1 . 65 = 6,5 (gam)
a) % Zn trong hỗn hợp ban đầu là:
(6,5 : 12,9) . 100% = 50,3876%
% Cu trong hỗn hợp ban đầu là:
100% - 50,3876% = 49,6124%
b) Số mol của axit là: 0,1 . 1 = 0,1(mol)
Khối lượng của axit là: 0,1 . 98 = 9,8 (gam)
C% = (9,8 : 400) . 100% = 2,45%
c) Tiếp theo áp dụng định luật bảo toàn khối lượng để tính khối lượng dung dịch muối sau phản ứng bằng cách Tính tổng khối lượng các chất phản ứng trừ đi khối lượng khí bay hơi... Từ đó ta tính được khối lượng dung dịch muối sau pứ là: 406,3(gam)
Khối lượng chất tan (khối lượng muối) là:
0,1 . 161 = 16,1 (gam)
C% của dung dịch muối sau pứ là:
16,1 : 406,3 = 3,9626%

nA = = 0,015625 mol.
MA = = 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x = 32g => nO =
= 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
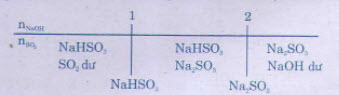
b) Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:
Bài 7*. a) Hãy xác định công thức của hợp chất khí A, biết rằng :
- A là oxit của lưu huỳnh chứa 50% oxi.
- 1 gam khí A chiếm thề tích là 0,35 lít ở đktc.
b) Hoà tan 12,8 gam hợp chất khí A vào 300 ml dung dịch NaOH 1,2M. Hãy cho biết muối nào thu được sau phản ứng. Tính nồng độ mol của muối (giả thiết thể tích dung dịch thay đổi không đáng kể).
Lời giải:
nA = = 0,015625 mol.
MA = = 64g
- Tìm số nguyên tử S, O trong phân tử A?
mO = 64 x = 32g => nO =
= 2 mol
mS = 64 - 32 = 32g => ns = = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
b) * Hướng dẫn: Khi dẫn SO2 vào dung dịch NaOH và SO2, có thể tạo thành muối trung hoà, muối axit hoặc cả hai muối:

\(a)n_{H_2}=\dfrac{7,437}{24,79}=0,3mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 0,1 0,3
\(\%m_{Al}=\dfrac{0,2.27}{15,6}\cdot100=34,62\%\\ \%m_{Al_2O_3}=100-34,62=65,38\%\\ b)n_{Al_2O_3}=\dfrac{\left(15,6-0,2.27\right)}{102}=0,1mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
0,1 0,15 0,05 0,15
\(m_{ddH_2SO_4}=\dfrac{\left(0,3+0,15\right).98}{9,8}\cdot100=450g\)
c) \(C_{\%Al_2\left(SO_4\right)_3}=\dfrac{\left(0,1+0,05\right)342}{15,6+450-0,3.2}\cdot100=11\%\)