
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Tính chất hóa học của nước Gia- ven
- Nước Gia-ven là hỗn hợp muối NaCl và NaClO là muối của axit yếu, trong không khí tác dụng với CO2 cho HClO không bền có tính oxi hóa mạnh.
NaClO + CO2 + H2O → NaHCO3 + HClO
2HClO → 2HCl + O2
- Nước Gia- ven không để được lâu, có tính oxi hóa mạnh.
b) Tính chất hóa học của clorua vôi
- Clorua có tính oxi hóa mạnh, khi tác dụng với dung dịch HCl giải phóng khí Clo:
CaOCl2 + 2HCl \(\rightarrow\) CaCl2 + Cl2\(\uparrow\) + H2O
- Trong không khí ẩm, clorua vôi tác dụng với CO2
2CaOCl2 + CO2 + H2O \(\rightarrow\) CaCO3 \(\downarrow\)+ CaCl2 + 2HClO
c) Ứng dụng của nước Gia-ven và clorua vôi
- Ứng dụng của nước Gia-ven
Dùng để tẩy trắng sợi vải, giấy. Nó cũng được dùng để khử mùi,sát trùng khi tẩy uế nhà vệ sinh hoặc những khu vực bị ô nhiễm khác.
- Ứng dụng của clorua vôi:
Cũng dùng để tẩy trắng sợi vải, giấy, để tẩy uế các hố rác, cống rãnh. Do khả năng tác dụng nhiều với chất hữu cơ, clorua vôi dùng để xử lí các chất độc. Một lượng lớn clorua vôi được dùng trong việc tinh chế dầu mỏ
a) Tính chất hóa học của nước Gia- ven
– Nước Gia-ven là hỗn hợp muối NaCl và NaClO là muối của axit yếu, trong không khí tác dụng với CO2 cho HClO không bền có tính oxi hóa mạnh.
NaClO + CO2 + H2O → NaHCO3 + HClO
2HClO → 2HCl + O2
– Nước Gia- ven không để được lâu, có tính oxi hóa mạnh.
b) Tính chất hóa học của clorua vôi
– Clorua có tính oxi hóa mạnh, khi tác dụng với dung dịch HCl giải phóng khí Clo:
CaOCl2 + 2HCl \(\rightarrow\) CaCl2 + Cl2\(\uparrow\) + H2O
– Trong không khí ẩm, clorua vôi tác dụng với CO2
2CaOCl2 + CO2 + H2O \(\rightarrow\) CaCO3 \(\downarrow\) + CaCl2 + 2HClO
c) Ứng dụng của nước Gia-ven và clorua vôi
– Ứng dụng của nước Gia-ven
Dùng để tẩy trắng sợi vải, giấy. Nó cũng được dùng để khử mùi,sát trùng khi tẩy uế nhà vệ sinh hoặc những khu vực bị ô nhiễm khác.
– Ứng dụng của clorua vôi:
Cũng dùng để tẩy trắng sợi vải, giấy, để tẩy uế các hố rác, cống rãnh. Do khả năng tác dụng nhiều với chất hữu cơ, clorua vôi dùng để xử lí các chất độc. Một lượng lớn clorua vôi được dùng trong việc tinh chế dầu mỏ

a) Br thuộc nhóm VIIA, chu kì 4 có 35 electron nên cấu hình theo lớp electron là 2, 8, 18, 7. Nó có 7e lớp ngoài cùng nên là phi kim. Hóa trị cao nhất với oxi là VII. Hóa trị trong hợp chất khí với hiđro là I và có công thức phân tử là HBr.
b) Tính phi kim giảm dần Cl, Br, I.

Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh, các nguyên tử này rất hoạt động vì chúng dễ thu thêm 1 electron, tính oxi hóa của các halogen giảm dần từ flo đến iot. Sở dĩ tính oxi hóa giảm dần từ flo đến iot là do:
- Độ âm điện giảm dần từ flo đến iot.
- Từ flo qua clo đến brom và iot, lớp electron ngoài cùng càng xa hạt nhân hơn, bán kính nguyên tử tăng dần, lực hút của hạt nhân với electron ngoài cùng càng yếu hớn, làm cho khả năng nhận electron của halogen giảm dần.

CÁC KIỂU MẠNG TINH THỂ THƯỜNG GẶP :
1: Mạng lập phương thể tâm
a) Dạng thực ô cơ sở b) Phần thể tích các nguyên tử trong 1 ô c) Khối cơ bản
Những nguyên tử trên phương đường chéo khối (a 3 ) tiếp xúc với nhau còn theo phương đường chéo mặt và cạnh a xếp rời nhau tạo nên những lỗ hổng có kích thước bé
a: gọi là thông số mạng (hằng số mạng, chu kỳ mạng…)
Mật độ nguyên tử của mạng (mật độ khối) là phần thể tích tính ra % của mạng do
các nguyên tử chiếm chỗ được xác định bằng công thức
Mv = (n.v)/V x 100% Số nguyên tử trong ô mạng n = Bán kính nguyên tử: r =( a 3 )/4
Thể tích của 1 nguyên tử : v = 4/3 ð.r Thể tích ô mạng: V = a
Ta tính được Mv = 68% . Mv càng cao thì thể tích riêng nhỏ, KLR cao
- Thông số mạng là kích thước cơ bản của mạng tinh thể, ở đây có thể tính ra được khoảng cách 2 ngtử bất kỳ trong mạng
Thông số mạng được đo bằng Ao hay kX
1 Ao = 10-8 cm
1 kx = 1,00202 Ao
Mạng LPTT chỉ có 1 TSM là a. khoảng cách 2 ngtử gần nhau nhất là d Các kim loại có kiểu mạng này là Fe
2. Mạng lập phương diện tâm:
Các nguyên tử (ion) nằm ở các đỉnh và giữa (tâm) các mặt của hình lập phương.
Các kim loại: Fe, Cu, Ni, Al, Pb… có kiểu mạng lập phương diện tâm.
a) Dạng thực ô cơ sở b) Phần thể tích các nguyên tử trong 1 ô
Các nguyên tử xếp sít nhau trên phương đường chéo mặt nên mặt tinh thể chéo hợp bởi phương này có các nguyên tử xếp sít nhau. Trên phương đường chéo khối và cạnh a các nguyên tử xếp rời nhau và tạo nên các lỗ hổng với số lượng ít hơn song kích thước lớn hơn
Mv = 74% với n = … Khoảng cách 2 ngtử gần nhau hay d =.
Các ngtử có kiểu mạng này là : Fễ, Cu, Ni, Al, Pb…
VD: ở nhiệt độ > 911 độ Fễ có kiểu mạng LPDT với a = 2,93 Ao
3. Mạng lục giác xếp chặt
a) Dạng thực ô cơ sở b) Phần thể tích các nguyên tử trong 1 ô c) Khối cơ bản
Bao gồm 12 nguyên tử nằm ở các đỉnh, 2 nguyên tử nằm ở giữa 2 mặt đáycủa hình lăng trụ lục giác và 3 nguyên tử nằm ở khối trung tâủ khối lăng trụ tam giác cách nhau.
Khối cơ bản kiểu mạng này như gồm bởi 3 lớp nguyên tử xếp sít nhau, các ngtử lớp đáy dưới xếp sít nhau rồi đến 3 ngtử ở giữa xếp vào khe lõm của lớp đáy do đó chúng cũng xếp sít nhau, các ngtử lớp đáy trên lại xếp vào các khe lõm của lớp giữa nhưng có vị trí trùng với vị trí lớp đáy dưới
Mv = 74% . Kiểu mạng này có 2 thông số mạng là a và c. Vì các lớp xếp sít nhau
nên a và c lại có sự tương quan
Trường hợp lý tưởng c/a = 1,633 (√8/3 ). Thực tế ít gặp nên người ta quy ước nếu
c/a trong khoảng 1,57 đến 1,64 được coi là xếp chặt
VD: c/a của Be = 1,5682 ; Mg = 1,6235. Khi c/a khác giá trị trên quá nhiều thì được coi là không xếp chặt
VD: c/a của Zn = 1,8563 ; của Cd = 1,8858 c/a được gọi là độ chính phương
4. Mạng chính phương thể tâm
Các kim loại không có kiểu mạng này, song đây là 1 kiểu mạng rất quan trọng của một tổ chức khi nhiệt luyện có được ( Kiểu mạng của tổ chức Maxtenxit ) có thể coi mạng CPTT là LPTT bị kéo dài ra theo trục Z
Nó có 2 thông số mạng là c và a. tỷ số c/a được coi là độ chính phương

a)
Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl \(\rightarrow\) MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl \(\rightarrow\)2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl \(\rightarrow\)2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 \(\rightarrow\) nmol Cl2
Theo (2) nmol KMnO4 \(\rightarrow\) 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 \(\rightarrow\) 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều hơn Cl2 hơn
Clo oxi hóa dễ dàng Br – tronh dung dịch muối bromua và I- trong dung dịch muối iotua.
Cl2 + 2NaBr \(\rightarrow\) 2NaCl + Br2
Cl2 + 2NaI \(\rightarrow\) 2NaCl + I2

a) Cấu hình electron của nguyên tử Mg: 1s22s22p63s2.
Mg có 2e ở lớp ngoài cùng nên thể hiện tính kim loại, hóa trị cao nhất với oxi là II, chất MgO là oxit bazơ và Mg(OH)2 là bazơ.
b) Na:1s22s22p63s1.
Mg: 1s22s22p63s2
Al: 1s22s22p63s23p1
- Có 1, 2, 3 electron ở lớp ngoài cùng nên đều là kim loại.
- Tính kim loại giảm dần theo chiều Na, Mg, Al.
- Tính bazơ giảm dần theo chiều NaOH, Mg(OH)2, Al(OH)3.

Cho hỗn hợp qua dung dịch NaOH, khí clo tác dụng với dung dịch NaOH, ta thu được khí O2
Cl2 + 2NaOH \(\rightarrow\) NaCl + NaClO + H2O
cho hỗn hợp qua quỳ tím ẩm thì clo sẽ bị dữ lại, oxi ít tan trong nước sẽ bay ra
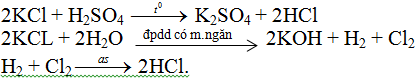
Hdro clorua là khí không màu, mùi xốc, nặng hơn không khí, khí clorua tan nhiều trong nước tạo thành dung dịch axit, ở 0oC một thể tích nước hòa tan 500 thể tích hidro clorua
Hidro clorua là khí không màu, mùi xốc, nặng hơn không khí, khí clorua tan nhiều trong nước tạo thành dung dịch axit, ở 0oC một thể tích nước hòa tan 500 thể tích hidro clorua.