Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n H2O = 1,08 / 18 = 0,06 (mol)
=> nH = 0,06 x 2 = 0,12 (mol)
=> mH = 0,12 x 1 = 0,12 (g)
n SO2 = 1,344 / 22,4 = 0,06 (mol)
=> n S = 0,06 (mol)
=> m S = 0,06 x 32 = 1,92 (g)
Vì: mO = mhh - mS - mH = 2,04 - 1,92 - 0,12 = 0 => Không có Oxi
Gọi HxSy là chất cần tìm
nH : nS = 0,12 : 0,06 = 2 : 1
=> Công thức đơn giản là (H2S)n
(H2S)n + 3n/2O2 --> nH2O + nSO2
____ __ _ __ _ _ _ _ 0,06 ----> 0,06n
lấy số mol nước đẩy qua số mol SO2 thì thấy 0,06n = 0,06 => n = 1
n H2S = 0,06 (mol)
Vậy đó là công thức H2S
2AgNO3 + H2S --> Ag2S + 2HNO3
0,06 ----> 0,06
=> m Ag2S = 0,06 x 248 = 14,88 g

Phương trình hóa học của phản ứng:
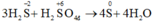
Do H2S có tính khử và H2SO4 có tính oxi hóa nên chúng có khả năng tác dụng với nhau sinh ra kết tủa vàng là S
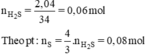
mS = 0,08 × 32 = 2,56g.

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2
FeS + 2HCl → FeCl2 + H2S
H2S + Pb(NO3)2 → PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.
nhh khí = 2,464 / 22,4 = 0,11 mol; nPbS = 23,9 /239 = 0,1 mol.
a) Phương trình hóa học của phản ứng:
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
FeS + 2HCl \(\rightarrow\) FeCl2 + H2S
H2S + Pb(NO3)2 \(\rightarrow\) PbS + 2HNO3
nH2S = nPbS = 0,1 mol.
Gọi nFe = x; nFeS = y.
b) Hỗn hợp khí thu được là H2 và H2S
Theo phương trình phản ứng hóa học trên ta có:
Ta có x + y = 0,11.
Có nFeS = nH2S = 0,1.
x = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) mFe = 56 × 0,01 = 0,56g; mFeS = 0,1 × 88 = 8,8g.

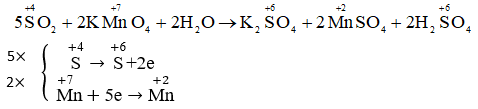
Xác định công thức phân tử của hợp chất A
nSO2 = 1,344 / 22,4 = 0,06 mol → mS = 0,06 x 32 = 1,92g
nH2O = 1,08 / 18 = 0,06 mol → mH = 0,06 x 2 = 0,12g.
Như vậy hợp chất A chỉ có nguyên tố S và H.
Đặt công thức phân tử hợp chất là HxSy.
Ta có tỉ lệ: x : y = 0,06 : 0,12 = 1: 2.
Vậy công thức phân tử của A và là H2S.
Phương trình hóa học của phản ứng:
nH2S = 2,04 / 34 = 0,06 mol.
3H2S + H2O → 4S + 4H2O.
nS = 4/3 nH2S = 0,08 mol.
mS = 0,08 × 32 = 2,56g.
Xác định công thức phân tử của hợp chất A
nSO2 = 1,344 / 22,4 = 0,06 mol → mS = 0,06 x 32 = 1,92g
nH2O = 1,08 / 18 = 0,06 mol → mH = 0,06 x 2 = 0,12g.
Như vậy hợp chất A chỉ có nguyên tố S và H.
Đặt công thức phân tử hợp chất là HxSy.
Ta có tỉ lệ: x : y = 0,06 : 0,12 = 1: 2.
Vậy công thức phân tử của A và là H2S.
Phương trình hóa học của phản ứng:
nH2S = 2,04 / 34 = 0,06 mol.
3H2S + H2O \(\rightarrow\) 4S + 4H2O.
nS = 4/3 nH2S = 0,08 mol.
mS = 0,08 × 32 = 2,56g.