Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có (mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl = %.
%mFe = 50,91 %.
Theo lượng chất :
%nAl = 66,67%.
%Fe = 33,33%.
)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có
(mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl =
%.
%mFe = 50,91 %.
Theo lượng chất :

a. Fe + S \(\rightarrow\) FeS
2Al + 3S \(\rightarrow\) Al2S3
b. Gọi x, y lần lượt là số mol của sắt và nhôm ta có:
PT: Fe + S \(\rightarrow\) FeS
theo đề x(mol) x(mol)
2Al + 3S \(\rightarrow\) Al2S3
y(mol) (3/2)y (mol)
Theo đề bài ta có hệ: 56x + 27y = 1,1
x + (3/2)y = 1,28/32= 0.04
Giải hệ ta được x= 0.01; y=0.02
KHối lượng sắt trong hỗn hợp là:56x = 56x0.01=0.56 g
+> %Fe=(0.56/1.1)x100%= 50.9%
=> %Al= 100% - 50.9% = 49,1%

Gọi nFe = x mol, theo PT ⇒ nS (1) = nFe = x mol
Gọi nAl = y mol, theo PT ⇒ nS (2) = 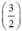 . nAl =
. nAl = 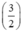 . y mol
. y mol
⇒ nS = x + 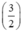 . y = 0,04 mol.
. y = 0,04 mol.
mhh = 56x + 27y = 1,1.
Giải hệ phương trình ta có x = 0,01 mol, y= 0,02 mol.
Tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
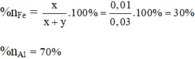
Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
mAl = 0,02 x 27 = 0,54g
mFe = 0,01 x 56 = 0,56g.
%mAl = 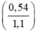 × 100% = 49,09%
× 100% = 49,09%
%mFe = 100% - 49,09% = 50,91%

Phương trình hóa học của phản ứng
Fe + S → FeS
2Al + 3S → Al2S3

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

a) Hai phương pháp điều chế H2S từ những chất trên.
Fe + S -> FeS (1)
FeS + H2SO4 -> FeSO4 + H2S (2)
Fe + H2SO4 -> FeSO4 + H2 (3)
H2 + S -> H2S (4)
b) Vai trò của S trong phản ứng (1), (4) : S là chất oxi hóa.
Đỗ Hương Giang21 tháng 4 2017 lúc 19:40
a) Hai phương pháp điều chế H2S từ những chất trên.
Fe + S -> FeS (1)
FeS + H2SO4 -> FeSO4 + H2S (2)
Fe + H2SO4 -> FeSO4 + H2 (3)
H2 + S -> H2S (4)
b) Vai trò của S trong phản ứng (1), (4) : S là chất oxi hóa.


nS = 1,28 / 32 = 0,04 mol.
a) Phương trình hóa học của phản ứng
Fe + S → FeS
nS = 1,28 / 32 = 0,04 mol.
a) Phương trình hóa học của phản ứng
Fe + S → FeS