Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Độ tan của NaCl : \(S=\dfrac{28,72}{80}.100=35,9\left(g\right)\)
=> Chọn B

ở 800 C
28,3 gam Na2SO4 + 100 g H2O---> 128,3 gam dd bão hòa
=> x gam Na2SO4 + y gam H2O---> 1023,4 gam dd bão hòa
=> x = 225,7 gam ; y = 79,7 gam
ở 100 C
9 gam Na2SO4 + 100g H2O--> dd bão hòa
=> z (g ) Na2SO4+ 79,7g H20--> dd bão hòa
=> z= 7,173 gam
=> có 225,7-7,173 = 218,527 gam Na2SO4 tách ra.
Na2SO4+10H2O→Na2SO4.10H2ONa2SO4+10H2O→Na2SO4.10H2O
nNa2SO4 = 218,527/142= 1,5 mol
theo PTHH => nNa2SO4.10H2O = nNa2SO4 = 1,5 mol
=> khối lượng Na2So4.10H2O tách ra là 1,5.322=483 gam
Vậy...

chắc là chỉ có 100oC thui nhỉ :))
\(S_{100^O}=\dfrac{180}{100}.100=180g\)
80g nước hòa được tối đa : \(\dfrac{180.80}{100}=144gNaNO_3\)
=> dd chưa bão hòa
để thu đc dd bảo hòa cần : 180 - 130 = 50g NaNO3

Cứ 190 gam H 2 O hòa tan hết 60 gam KNO 3 tạo dung dịch bão hòa
100 gam H 2 O hòa tan hết x gam KNO 3 .
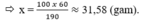

Ta có trong 100(g) nước có được 250(g) dung dịch Na2SO4 20%
Ta lại có: \(C_{\%_{Na_2SO_4}}=\dfrac{m_{Na_2SO_4}}{250}.100\%=20\%\)
=> \(m_{Na_2SO_4}=50\left(g\right)\)
=> \(S=\dfrac{50}{100}.100=50g_{Na_2SO_4}\)
Vậy ở 600oC trong 100 gam nước, độ tan của Na2SO4 là 50 gam.

Độ tan của NaCl ở 25 độ C là 36 gam, nghĩa là:
100 gam \(H_2O\) hòa tan được 36 gam NaCl:
Suy ra với 80 gam \(H_2O\) sẽ hòa tan được: \(\dfrac{36}{100}.80=28,8\left(g\right)\)
Ta có: \(24\left(g\right)< 28,8\left(g\right)\Rightarrow\) dung dịch NaCl chưa bão hòa
Cần thêm khối lượng NaCl để dung dịch được bảo hòa:
\(28,8-24=4,8\left(g\right)\)

a) mdd =15+65=80g
b)
⇒SNa2CO3=\(\dfrac{53}{250}\).100=21,2g
Vậy độ tan của muối Natricacbonat ở 18 độ C là 21,2g
a. mdd = 15+65 = 80 (g)
b. Độ tan của muối Na2CO3 ở 18^oC là : S = (53 x 100)/250 = 21,2 (gam).
\(S_{Na_2SO_4}=\dfrac{7.2}{80}\cdot100=9\left(g\right)\)
C.9 gam