Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
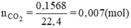
BT nguyên tố ⇒ nC = nCO2 = 0,007 mol
Khối lượng C là mC = 12. 0,007 = 0,084 (g)
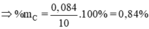

Số mol hỗn hợp: nCO, CO2 = 15,68 /22,4 = 0,7
Gọi số mol CO và CO2 là x và y (x, y > 0)
Ta có PTĐS: x + y = 0,7 => x = 0,7 – y (1)
28x + 44y = 27,6 (2)
Thay x = 0,7 – y vào (2) giải ra ta được: x = 0,2; y = 0,5
mCO = 0,2.28 = 5,6 gam; mCO2 = 0,5.44 = 22 gam
%mCO2 = 79,7% ; % mCO = 20,3 %
Theo đầu bài có tỉ lệ:
\(\frac{M_{CaSO_4.nH_2O}}{m_{CaSO_4.nH_2O_{ }}}=\frac{M_{H_2O}}{m_{H_2O}}=\frac{136+18n}{19,11}=\frac{18n}{4}\)
Giải ra ta được n = 2
Vậy CTHH là : CaSO4 . 2H2O

Gọi a và b lần lượt là số mol của nhôm và của nhôm nitrat.
mX=mnhôm nitrat ⇔ 27a+213b=\(\dfrac{a+b}{2}\).102 ⇔ b=\(\dfrac{4}{27}\)a.
BTe: 3nnhôm=3nNO=3.0,81 ⇒ nnhôm=a=0,81 mol ⇒ b=nnhôm nitrat=0,12 mol.
Rắn khan trong Y chỉ chứa Al(NO3)3 (0,81+0,12=0,93 (mol)) với khối lượng là 0,93.213=198,09 (g).
Chọn B.

Fe2O3 + 2Al -to-> 2Fe + Al2O3
nH2 (1) = 0.75 mol
nH2 (2) = 3.75 mol
Vì : Phần (1) + NaOH --> H2
=> Al dư
Đặt :
nFe2O3 = x mol
2Al + Fe2O3 -to-> Al2O3 + 2Fe
2x_____x__________x_____2x
P1 :
NaOH + Al + H2O --> NaAlO2 + 3/2H2
_______0.5____________________0.75
P2:
Đặt :
nFe = 2kx mol
nAl dư = 0.5k mol
nAl2O3 = kx mol
Fe + 2HCl --> FeCl2 + H2
2kx________________2kx
2Al + 6HCl --> 2AlCl3 + 3H2
0.5k__________________0.75k
<=> k ( 2x + 0.75 ) = 3.75
=> k = 3.75/(2x + 0.75 )
mP2 - mP1 = 134
<=> 56*2kx + 0.5k*27 + 102kx - ( 2x*56 + 27*0.5 + 102x) = 134
<=> 112kx + 13.5k + 102kx - 112x - 13.5 - 102x = 134
<=> 214kx + 13.5k - 214x = 147.5
<=> 214x( k - 1 ) + 13.5k = 147.5
<=> 214x [3.75/(2x + 0.75) - 1 ) + 13.5[3.75/(2x + 0.75)] = 147.5
<=> x = 60/107
Tới đây thì em tự thế số mol vào tính nhé


$C + O_2 \xrightarrow{t^o} CO_2$
$n_C = n_{CO_2} = \dfrac{0,1568}{22,4} = 0,007(mol)$
$\%m_C = \dfrac{0,007.12}{10}.100\% = 0,84\%$
Đáp án B