Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
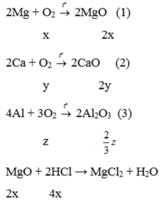

Áp dụng định luật bảo toàn khối lượng cho PT (1), (2), (3), ta có:
![]()
![]()
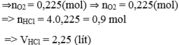

Giả sử khối lượng hỗn hợp rắn ban đầu là m gam => khối lượng rắn sau phản ứng là (m – 0,32) gam


CO tác dụng với hỗn hợp oxit dư thu được khí X là C O 2 .
C O 2 tác dụng với C a O H 2 dư thu được muối duy nhất là kết tủa C a C O 3
⇒ n C O 2 = n N a C O 3 = 4/100 = 0,04 mol
⇒ nCO = n C O 2 = 0,04 mol
⇒ VCO = 0,04.224 = 0,896 lit
⇒ Chọn A.

Gọi: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=x\left(mol\right)\\n_{CuO}=y\left(mol\right)\end{matrix}\right.\) ⇒ 160x + 80y = 16 (1)
\(n_{HCl}=0,55.1=0,55\left(mol\right)\)
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
BTNT H, có: nHCl = 2nH2O + 2nH2 ⇒ nH2O = 0,25 (mol)
BTNT O, có: 3nFe2O3 + nCuO = nH2O ⇒ 3x + y = 0,25 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\dfrac{0,05.160}{16}.100\%=50\%\\\%m_{CuO}=50\%\end{matrix}\right.\)
Dd Y gồm: FeCl3: 0,1 (mol) và CuCl2: 0,1 (mol)
Dd Z gồm: FeCl2 và ZnCl2
Chất rắn T gồm: Cu, Fe
BTNT Cu: nCu = nCuCl2 = 0,1 (mol)
Ta có: \(n_{Fe\left(OH\right)_2}=\dfrac{4,5}{90}=0,05\left(mol\right)\)
BTNT Fe, có: nFeCl2 = 0,05 (mol) ⇒ nFe = 0,1 - 0,05 = 0,05 (mol)
BT e, có: 2nZn = 2nH2 + 2nCu + 3nFe + 2nFeCl2
⇒ nZn = 0,25 (mol)
⇒ m = 0,25.65 = 16,25 (g)

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

Gọi số mol của BaO, BaCO3, NaHCO3 trong 30,19g hh lần lượt là x, y, z
Có 153x + 197y + 84z = 30,19
Phần 1:
BaO + H2O → Ba(OH)2
x x
OH- + HCO3- → CO32- + H2O
Ba2+ + CO32- → BaCO3
n kết tủa = 0,11
Phần 2:
BaCO3 →BaO + CO2
y y
2NaHCO3 → Na2CO3 + H2O + CO2
z z/2 z/2
=> mCO2 + mH2O = 30,19 – 26,13 = 4,06
=> 44 (y + z/2) + 18 . z/2= 4,06
TH1: Ba tạo kết tủa hoàn toàn thành BaCO3 và NaHCO3 dư
=> nBaCO3 = nBaCO3 + nBaO = 0,11 => Không thỏa mãn
TH2: Ba(OH)2 dư và NaHCO3 hết
=> x + y = 0,11 và y + z = 0,11
=> x = 0,1; y = 0,05 và z = 0,06
a.
hh Y gồm BaO: 0,15 mol; Na2CO3: 0,03 mol
BaO + H2O → Ba(OH)2
0,15 0,15
Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH
0,15 0,03 0,03 0,06
=> m kết tủa = 0,03 . 197 = 5,91g
m dd = m chất rắn + mH2O – mBaCO3 = 26,13 + 79,78 – 5,91 = 100
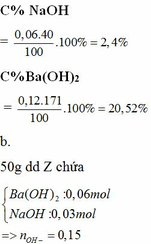
nAl2(SO4)3 = 0,02 => nAl3+ = 0,04; nSO42- = 0,06
Ba2+ + SO42- → BaSO4
0,06 0,06 0,06
nAl(OH)3 = 0,01 => mAl(OH)3 = 0,78g
m = 0,78 + 0,06 . 233 = 14,76g


\(Fe_2O_3+2Al\rightarrow\left(t^o\right)Al_2O_3+2Fe\\ n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
TH1: Nếu p.ứ vừa đủ thì ta có:
\(hh.rắn.X:0,1\left(mol\right)Al_2O_3.và.0,2\left(mol\right)Fe\\ m_X=0,1.10,2+0,2.56=21,4\left(g\right)< 24,1\left(g\right)\)
=> P.ứ có dư. Nên loại TH1
TH2: Khi phản ứng có dư. Nếu dư Al.
\(m_{Al\left(dư\right)}=m-0,2.27=m-5,4\left(g\right)\\m_{Fe}=0,1.2.56=11,2\left(g\right)\\ m_{Al_2O_3}=0,1.102=10,2\left(g\right)\\ m_X=\left(m-5,4\right)+11,2+10,2=24,1\\ \Leftrightarrow m=8,1\left(g\right)\\ \Rightarrow n_{Al\left(dư\right)}=\dfrac{8,1}{27}-0,1=0,2\left(mol\right)\\ -VớiTH2:\\ 2Al_{dư}+6HCl\rightarrow2AlCl_3+3H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{HCl\left(tổng\right)}=0,2.3+0,1.6+0,2.2=1,6\left(mol\right)\\V_{ddHCl}=\dfrac{1,6}{1}=1,6\left(lít\right)=V \)
- TH3: Nếu Al hết, Fe2O3 dư
\(X.có:\dfrac{56m}{27}\left(g\right)Fe;\dfrac{17m}{9}\left(g\right)Al_2O_3;\left(16-\dfrac{80m}{27}\right)\left(g\right)Fe_2O_3\left(dư\right)\\ m_X=24,1=\dfrac{56m}{27}+\dfrac{17m}{9}+\left(16-\dfrac{80m}{27}\right)\\ \Leftrightarrow m=8,1\left(g\right)\\ n_{Al\left(bđ\right)}=0,3\left(mol\right)>n_{Fe_2O_3}\left(LOẠI\right)\)
Vậy: V=1,6(lít)