Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a)n_{KMnO_4} = a; n_{KClO_3} = b\Rightarrow 158a + 122,5b = 99,95(1)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{O_2} = 0,5a +1,5b = \dfrac{14,56}{22,4}=0,65(2)\\ (1)(2)\Rightarrow a = 0,4 ; b = 0,3\\ \%m_{KMnO_4} = \dfrac{0,4.158}{99,95}.100\% = 63,23\%\\ \%m_{KClO_3} = 100\%-63,23\% = 36,77\%\)
\(n_{K_2MnO_4} = n_{MnO_2} = 0,5a = 0,2(mol)\\ n_{KClO_3} = b = 0,3(mol)\\ m_{hh\ sau\ pư} = 99,95 - 0,65.32 = 79,15(gam)\\ \%m_{K_2MnO_4} = \dfrac{0,2.197}{79,15}.100\% = 49,78\%\\ \%m_{MnO_2} = \dfrac{0,2.87}{79,15},100\% = 21,98\%\\ \%m_{KCl} = 28,24\%\)

2K2MnO4-toK2MnO4+MnO2+O2
nKMnO4=15,8/158=0,1 mol
->nK2MnO4=nMnO2=0,05 mol
mcr=0,05.197+0,05.87=14,2g
H,=14,2/14,5=97,7%
\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1mol\)
Gọi \(n_{KMnO_4}=x\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
x 1/2 x 1/2 x ( mol )
Ta có:
\(158\left(0,1-x\right)+\dfrac{1}{2}x\left(197+87\right)=14,52\)
\(\Leftrightarrow x=0,08mol\)
\(H=\dfrac{0,08}{0,1}.100=80\%\)

a) PTHH: 2KMnO4 \(\underrightarrow{t^o}\) K2MnO4 + MnO2 + O2
Áp dụng ĐLBT khối lượng: Khối lượng chất rắn giảm sau phản ứng chính là khối lượng khí O2 tạo thành.
Khối lượng O2 thu được là: 79 - 72,6 = 6,4 g
Số mol khí O2 là: 6,4 : 32 = 0,2 mol
Theo PTHH, số mol KMnO4 bị nhiệt phân là: 2.0,2= 0,4 mol
Khối lượng KMnO4 bị nhiệt phân là: 0,4.158 = 63,2 g < 79 g
Chứng tỏ KMnO4 bị nhiệt phân không hoàn toàn
Khối lượng KMnO4 dư là: 79 - 63,2 = 15,8 g
Số mol KMnO4 thu được là: 0,2 mol
Khối lượng KMnO4 thu được là: 0,2.197 = 39,4 g
Trong hỗn hợp X gồm KMnO4 dư, MnO2 , K2MnO4
Vậy thành phần % khối lượng các chất trong hỗn hợp X là:
% KMnO4 = \(\dfrac{15,8.100\%}{72,6}\)= 21,76%
% K2MnO4 = \(\dfrac{39,4.100\%}{72,6}\)= 54,27 %
% MnO2 = 100% - 21,76% - 54,27 % = 23,97%
b)
Hiệu suất phản ứng nhiệt phân KMnO4 là:
H% =\(\dfrac{63,2.100\%}{79}\)= 80%
pt: 2KMnO4---t*-->K2MnO4+MnO2+O2
Áp dụng định luật bảo toàn khối lượng:
mO2=mKMnO4-mhhX=79-72,6=6,4(g)
=>nO2=6,4/32=0,2(mol)
Theo pt: nKMnO4=2nO2=2.0,2=0,4(mol)
=>mKMnO4=0,4.158=63,2(g)
=>mKMnO4 dư=79-63,2=15,8(g)
Theo pt: nK2MnO4=nO2=0,2(mol)
=>mK2MnO4=0,2.197=39,4(g)
=>%K2MnO4=39,4/72,6.100~54,27%
Theo pt: nMnO2=nO2=0,2(mol)
=>mMnO2=0,2.87=17,4(g)
=>%mMnO2=17,4/72,6.100~23,97%
=>%KMnO4 dư=100%-23,97%-54,27%=21,76%
b) H%=63,2/79.100=80%

Pt: 2Pb(NO3)2 --to--> 2PbO + 4NO2 + 4O2
...........x..........................x
nPb(NO3)2 ban đầu = 66,2\331=0,2 mol
Nếu Pb(NO3)2 bị nhiệt phân hết => nPb = 0,2 mol
=> mPbO = 0,2 . 223 = 44,6g < 55,4g
Vậy Pb(NO3)2 ko bị nhiệt phân hết
Gọi x là số mol Pb(NO3)2 pứ
Ta có: mPb(NO3)2 dư + mPbO = 55,4
<=> (0,2 - x).331 + 223x = 55,4
=> x = 0,1
Hiệu suất pứ:
H = 0,1\0,2.100\%=50%
bài 2
pt: 2KMnO4---t*-->K2MnO4+MnO2+O2
Áp dụng định luật bảo toàn khối lượng:
mO2=mKMnO4-mhhX=79-72,6=6,4(g)
=>nO2=6,4/32=0,2(mol)
Theo pt: nKMnO4=2nO2=2.0,2=0,4(mol)
=>mKMnO4=0,4.158=63,2(g)
=>mKMnO4 dư=79-63,2=15,8(g)
Theo pt: nK2MnO4=nO2=0,2(mol)
=>mK2MnO4=0,2.197=39,4(g)
=>%K2MnO4=39,4/72,6.100~54,27%
Theo pt: nMnO2=nO2=0,2(mol)
=>mMnO2=0,2.87=17,4(g)
=>%mMnO2=17,4/72,6.100~23,97%
=>%KMnO4 dư=100%-23,97%-54,27%=21,76%
b) H%=63,2/79.100=80%
Bài 1
\(2Pb\left(NO3\right)2-->2PbO+4NO2+4O2\)
\(n_{Pb\left(NO3\right)2}=\frac{66,2}{331}=0,2\left(mol\right)\)
\(n_{PbO}=n_{Pb\left(NO3\right)2}=0,2\left(mol\right)\)
\(m_{PBO}=0,2.223=44,6\left(g\right)\)
\(H\%=\frac{44,6}{55,4}=80,5\%\)
Bài 2 : tham khảo nha


Gọi số mol CaCO3, MgCO3 là a, b (mol)
=> 100a + 84b = 14,2 (1)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
PTHH: CaCO3 --to--> CaO + CO2
a-------------------->a
MgCO3 --to--> MgO + CO2
b---------------------->b
=> a + b = 0,15
=> a = 0,1; b = 0,05
=> \(\left\{{}\begin{matrix}\%m_{CaCO_3}=\dfrac{100.0,1}{14,2}.100\%=70,42\%\\\%m_{MgCO_3}=\dfrac{0,05.84}{14,2}.100\%=29,58\%\end{matrix}\right.\)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15mol\)
\(CaCO_3\underrightarrow{t^o}CO_2+CaO\)
\(x\) \(\rightarrow\) \(x\)
\(MgCO_3\underrightarrow{t^o}MgO+CO_2\)
\(y\) \(\rightarrow\) \(y\)
\(\Rightarrow\left\{{}\begin{matrix}100x+84y=14,2\\x+y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\%m_{CaCO_3}=\dfrac{0,1\cdot100}{14,2}\cdot100\%=70,42\%\)
\(\%m_{MgCO_3}=100\%-70,42\%=29,57\%\)

a) \(2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\)
b)
\(n_{KClO_3} = \dfrac{36,75}{122,5} = 0,3(mol)\)
Theo PTHH :
\(n_{KCl} = n_{KClO_3} = 0,3(mol)\\ \Rightarrow m_{KCl} = 0,3.74,5 = 22,35(gam)\\ \Rightarrow m_{O_2} = m_{KClO_3} - m_{KCl} = 14,4(gam)\)
c)
Bảo toàn khối lượng :
\(m_{O_2} = 25 - 15,4 = 9,6(gam)\\ \Rightarrow n_{O_2} = \dfrac{9,6}{32} = 0,3(mol)\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,2(mol)\\ \Rightarrow m_{KClO_3} = 0,2.122,5 = 24,5(gam)\\ \%m_{tạp\ chất}= \dfrac{25-24,5}{25}.100\% = 2\%\)
\(a.\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(b.\)
\(n_{KClO_3}=\dfrac{36.75}{122.5}=0.3\left(mol\right)\)
\(\Rightarrow n_{O_2}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}\cdot0.3=0.45\left(mol\right)\)
\(m_{O_2}=0.45\cdot32=14.4\left(g\right)\)
\(m_{KCl}=0.3\cdot74.5=22.35\left(g\right)\)
\(c.\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(a.............a\)
\(m_{Cr}=m_{KCl}+m_{tc}=25-122.5a+74.5a=15.4\left(g\right)\)
\(\Rightarrow a=0.2\)
\(m_{O_2}=\dfrac{3}{2}\cdot0.2\cdot32=9.6\left(g\right)\)
\(m_{KClO_3}=0.2\cdot122.5=24.5\left(g\right)\)
\(m_{tc}=25-24.5=0.5\left(g\right)\)
\(\%m_{Tc}=\dfrac{0.5}{25}\cdot100\%-2\%\)
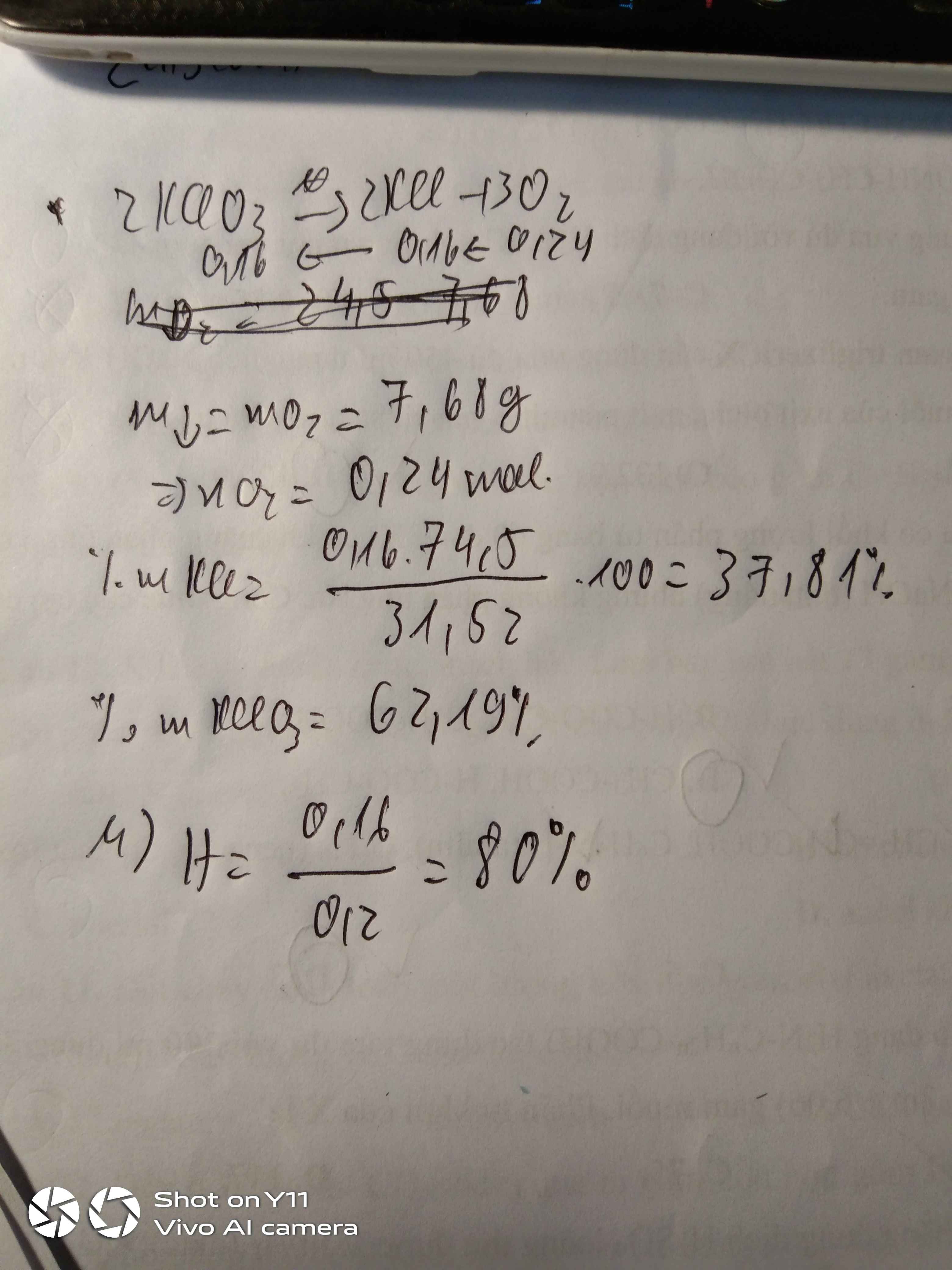
cảm ơn bn nhé