Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án: D
Nguyên tử nguyên tố X có ∑ephân lớp p = 8 → X có cấu hình e là 1s22s22p63s23p2
→ Z = 14 → Si

Đáp án D
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
=> X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p
=> Cấu hình electron của X là 1s22s22p63s23p2
=> Z=14 => X là Si

Đáp án D
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
→ X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p
→ Cấu hình electron của X là 1s22s22p63s23p2
→ Z=14 → X là Si

Chọn D
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
→ X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p


a. X: \(1s^{^2}2s^{^2}2p^{^4}\)
Vị trí: ô 8, chu kì 2, nhóm VIA (nguyên tố oxygen, O)
Y: \(1s^{^2}2s^{^2}2p^{^6}3s^{^2}3p^{^5}\)
Vị trí: ô 17, chu kì 3, nhóm VIIA (nguyên tố chlorine, Cl)
b. \(HClO,HClO_2,HClO_3,HClO_4\)
Tính acid tăng dần từ trái sang phải trong dãy trên vì trong phân tử acid cấu tạo từ các nguyên tố giống nhau thì phân tử nào chứa nhiều nguyên tử O hơn thì có tính acid mạnh hơn

Nguyên tử potassium có 19 electron => Cấu hình electron: 1s22s22p63s23p64s1
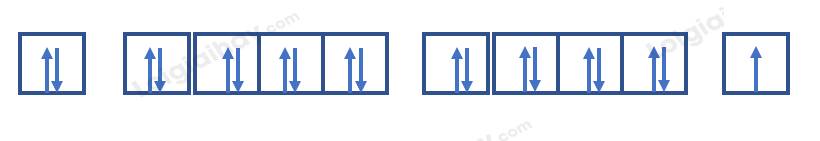
=> Có 10 orbital chứa electron
Đáp án D
Chọn D (9AO có 2e, 1AO có 1e)