Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HD:
Fe + CuSO4 ---> FeSO4 + Cu
x x mol x x
a) Khối lượng Fe tăng lên = mCu (thoát ra) - mFe (tan vào dd) ---> 4%.50 = 64.x - 56x ---> x = 0,25 mol.
---> mCu = 64x = 64.0,25 = 16 gam.
b) [FeSO4] = 0,25/0,4 = 0,625 M; [CuSO4] = (0,4 - 0,25)/0,4 = 0,375 M.

Fe + CuSO4 → FeSO4 + Cu
Gọi x là số mol pư của Fe
\(\Rightarrow m_{Fe}pư=56x\left(g\right)\)
Theo pT: \(n_{Cu}=n_{Fe}pư=x\left(mol\right)\)
\(\Rightarrow m_{Cu}=64x\left(g\right)\)
Ta có: \(m_{KL}tăng=m_{Cu}-m_{Fe}pư\)
\(\Leftrightarrow1=64x-56x\)
\(\Leftrightarrow1=8x\)
\(\Leftrightarrow x=0,125\left(mol\right)\)
Vậy \(n_{Fe}pư=n_{Cu}=0,125\left(mol\right)\)
a) \(m_{Cu}=0,125\times64=8\left(g\right)\)
b) Theo PT: \(n_{CuSO_4}=n_{Cu}=0,125\left(mol\right)\)
\(\Rightarrow m_{CuSO_4}=0,125\times160=20\left(g\right)\)
\(\Rightarrow m_{ddCuSO_4}=\frac{20}{10\%}=200\left(g\right)\)

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
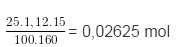
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:


bài 3
Cu +2 AgNO3 -> Cu(NO3)2 + 2Ag
x...............2x.................................2x (mol)
theo bài ta có : 216x-64x=152x=2,28
==> x=0,015 (mol)=> n AgNO3=2x=0,03
==> CMAgNO3 =\(\dfrac{0,03}{\dfrac{30}{1000}}=1\left(M\right)\)
vậy............
bài 1
Zn + CuSO4 -> ZnSO4 + Cu
x x x (mol)
theo bài có 161x-160x=0,2==> x=0,2 = nZn
==> mZn tham gia = 0,2.65=13 (g)
vậy.........

Bài 1 : Cách 1 :
Gọi x là số mol của Fe pư với CuSO4
Theo đề bài ta có :
\(Fe+C\text{uS}O4->FeSO4+Cu\)
xmol.....xmol................................xmol
Ta có :
\(\Delta m\left(t\text{ă}ng\right)=m_{kl-sau}-m_{kl-tr\text{ư}\text{ớc}}\)
<=> 64x - 56x = 1,6
<=> 8x = 1,6 => x = 0,2(mol)
=> nCuSO4 = 0,2 mol => CMCuSO4 = \(\dfrac{0,2}{0,2}=1\left(M\right)\)
Cách 2 :
Gọi x là khối lượng của Fe tham gia pư :
Ta có PTHH :
\(Fe+C\text{uS}O4->FeSO4+Cu\)
56g.......160g..............................64g
xg..........\(\dfrac{160x}{56}g\) .......................\(\dfrac{64x}{56}g\)
Ta có : \(\dfrac{64x}{56}-x=1,6\)
<=> \(\dfrac{8}{7}x-x=1,6< =>\dfrac{1}{7}x=1,6=>x=11,2\left(g\right)=>nFe\left(p\text{ư}\right)=\dfrac{11,2}{56}=0,2\left(mol\right)=nCuSO4=0,2\left(mol\right)=>CM_{C\text{uS}O4}=\dfrac{0,2}{0,2}=1\left(M\right)\)
Bài 2 :
Gọi x là số mol của Al tham gia pư
PTHH :
2Al + 3CuSO4 \(\rightarrow\) Al2(SO4)3 + 3Cu
xmol...........................................3/2xmol
Ta có :
\(\Delta m\left(t\text{ă}ng\right)=46,38-45=1,38\left(g\right)\)
<=> 96x - 27x = 1,38
<=> x = 0,02 (mol)
=> mCu = 0,02.64 = 1,28(g)
Vậy...

nH2 = \(\frac{2,24}{22,4}\) = 0,1 (mol)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,1 <------------- 0,1 <--- 0,1 (mol)
a) mFe = 0,1 . 56 = 5,6 (g)
mCu = 4 (g)
b) mFeCl2 = 0,1 . 127= 12,7 (g)
c) Gọi nZn pư = x (mol)
Zn + FeCl2 \(\rightarrow\) ZnCl2 + Fe
x ----->x --------> x -------> x (mol)
Khối lượng CR giảm là khối lượng của sắt sinh ra.
=> 65x - 56x = 100 - 99,55
\(\Rightarrow\) x = 0,05
Sau pư thể tích ko đổi nên V = 0,1 (l)
CM(ZnCl22) = \(\frac{0,05}{0,1}\) = 0,5 (M)
nFeCl2 dư = 0,1 - 0,05 = 0,05 (mol)
CM(FeCl2) = \(\frac{0,05}{0,1}\) = 0,5 (M)

Fe + CuSO4 -> FeSO4 + Cu
Gọi số mol của Fe tham gia PƯ là x
Ta có:
64x-56x=0,2
=>x=0,025
=>mCu bám vào=0,025.64=1,6(g)


a) Gọi x là số mol Fe tham gia phản ứng-> mFe=56x(g)
PTHH : Fe+CuSO4-> FeSO4 + Cu
Theo pthh ncu=nfe=x(mol)->mcu=64x(g)
Theo bài ta có: mcu-mfe=64x-56x=0,8->x=0,1(mol)
Khối lượng của sắt tham gia pứ là: mFe=Mfe*nFe=56*0,1=5,6(g)
b) Đổi 150ml=0,15l
Theo pthh ncuso4=nfe=0,1mol
Nồng độ cuso4 tham gia pứ là: Cmcuso4=ncuso4/vcuso4=0,1/0,15=0,6M