
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
2Cu+O2to→2CuO2Cu+O2→to2CuO
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
O2+2H2to→2H2OO2+2H2→to2H2O
+ Tác dụng với một số phi kim khác:
4P+5O2to→2P2O54P+5O2→to2P2O5
+ Tác dụng với một số hợp chất:
C2H5OH+3O2to→2CO2+3H2OC2H5OH+3O2→to2CO2+3H2O
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
3Fe+2O2to→Fe3O43Fe+2O2→toFe3O4
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
2KClO3
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
3Fe+2O2to→Fe3O43Fe+2O2→toFe3O4
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
2KClO3to→3O2↑+2KCl


- Phương pháp điều chế clo trong phòng thí nghiệm: Đun nóng nhẹ dung dịch HCl đậm đặc với chất oxi hóa mạnh như MnO2 (hoặc KMnO4).
MnO2 + 4HCl \(\underrightarrow{t^o}\) MnCl2 + Cl2 + 2H2O
Để thu được khí clo tinh khiết:
- Bình H2SO4 đặc có tác dụng làm khô khí clo.
- Clo nặng hơn không khí Þ Thu bằng cách đẩy không khí.
- Bông tẩm xút: tránh để clo độc bay ra ngoài.

mình chỉ góp ý về câu 4.1
Trên lý thuyết: khi cho Al vào dd CuSO4 thì Al sẽ đấy Cu ra khỏi muối tạo lớp Cu màu đỏ bám vào thanh Al, dd mất dần màu xanh
Nhưng, trên thực tế, khi cho Al vào dd CuSO4 thì ngoài các hiện tượng nêu trên (lý thuyết) thì dd còn có khí thoát ra nhiều và liên tục (H2)
thực ra thì không chỉ Al mà còn còn có Fe, Zn tác dụng với dd CuSO4, dd (CH3COO)2Cu tạo khí H2. Và lượng khí này thoát ra rất nhiều chứ không phải là ít, tới khi kết thúc pứ Cái này mình đã làm thí nghiệm nhiều lần và nó là hiện tượng thuộc dạng khó hiểu, đã tìm hiểu nhiều, hỏi mọi nơi mà không có kết quả. Nhưng gần đây mình nghĩ đó là hiện tượng pứ thứ cấp do tạo thành cặp pin điện hóa khi Cu tác dụng với kim loại Al thì Cu sẽ bám vào Al tạo thành cặp pin điện hóa Al - Cu với chất điện li là muối tan có sẵn. Cặp pin này pứ với H2O để tạo ra H2. Vấn đề này chỉ có thể giải thích bằng pin điện hóa chứ không thể bằng cách khác, vì bình thường Fe cũng không thể tác dụng với H2O mà sinh H2 không thể do dung dịch CuSO4 có tính axit vì (CH3COO)2Cu cũng có xảy ra hiện tượng với cường độ tương tự nhưng cơ chế thì đến bây giờ vẫn pó tay. =((
4.1: màu xanh của dd nhạt dần, có chất rắn màu nâu đỏ bám ngoài thanh nhôm. Phương trình: Al + CuSO4 ( xanh lam ) ---> Al2(SO4)3 + Cu ( nâu đỏ )
4.2: do dd H2SO4 đặc có tính oxi hóa .mạnh , axit đặc có tính háo nước, do vậy có thể ghi pứ như sau:
C12H22O11 - - H2SO4 đăc- - - > 6C + 6H2O
C + 2H2SO4 đặc - - > CO2↑ + 2H2O + 2SO2↑

Những oxit bị khử là: Fe3O4, CuO
Pt: Fe3O4 + 4H2 → 3Fe + 4H2O
CuO + H2 → Cu + H2O
Chú ý: Nhiệt luyện là phương pháp dùng (H2, CO) khử các oxit kim loại trung bình (–K, Na, Ca, Ba, Mg, Al)
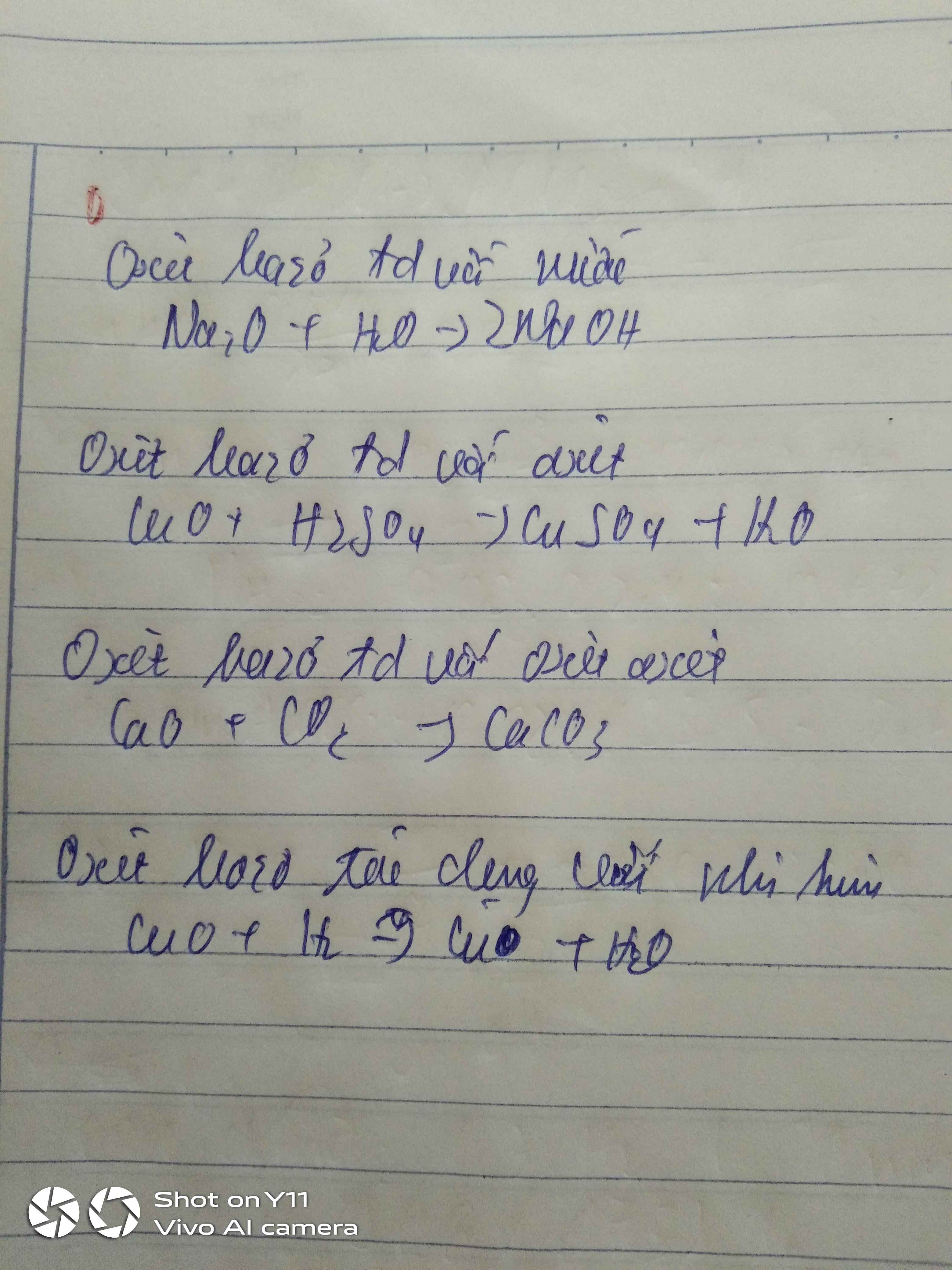
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
\(Na_2O+H_2O\rightarrow2NaOH\)
\(Ba\left(OH\right)_2+Na_2SO_4\rightarrow2NaOH+BaSO_4\downarrow\)
\(2NaCl+2H_2O\xrightarrow[có.màng.ngăn]{điện.phân}2NaOH+Cl_2+H_2\)