Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
KN03 --> KN02 + 1/2 02
b.
n 02 = 0,075 mol
mà H% đạt 85%
=> n 02 lí thuyết thu đc = 0,075*100/85 = 3/34 mol
KN03 --> KN02 + 1/2 02
3/17 mol <---- 3/34 mol
vậy n KN03 = 3/17 mol
c.
n KN03 = 0,1
KN03 ---> KN02 + 1/2 02
lí thuyết:..0,1 -----------------> 0,05
mà H% = 80%
=> n 02 thu được = 0,05*80/100 = 0,04 mol
=> V 02 thực tế thu dc = 0,896 lit

2KNO3\(\rightarrow\)2KNO2 + O2
b;nO2=\(\dfrac{2,4}{32}=0,075\left(mol\right)\)
Theo PTHH ta có:
nKNO3=2nO2=0,15(mol)
mKNO3 ban đầu=0,15.101=15,15(g)
mKNO3 thực tế=15,15.\(\dfrac{85}{100}=12,8775\left(g\right)\)
c;
nKNO3=\(\dfrac{10,1}{101}=0,1\left(mol\right)\)
Theo PTHH ta có:
\(\dfrac{1}{2}\)nKNO3=nO2=0,05(mol)
mO2 ban đầu=32.0,05=1,6(g)
mO2 thu được=1,6\(\dfrac{85}{100}=1,36\left(g\right)\)

a) \(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
Phản ứng phân hủy
b) \(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
PTHH: 2KNO3 --to--> 2KNO2 + O2
0,15<--------------------0,075
=> \(m_{KNO_3\left(PTHH\right)}=0,15.101=15,15\left(g\right)\)
=> mKNO3 (thực tế) = \(\dfrac{15,15.100}{85}=17,824\left(g\right)\)
c) \(n_{KNO_3\left(pư\right)}=\dfrac{10,1.80\%}{101}=0,08\left(mol\right)\)
=> nO2 = 0,04 (mol)
=> VO2 = 0,04.22,4 = 0,896(l)

\(n_{O_2}=\dfrac{0,64}{32}=0,02mol\\ 2KNO_3\xrightarrow[]{t^0}2KNO_2+O_2\\ n_{KNO_3\left(lí.thuyết\right)}=0,02.2=0,04mol\\ n_{KNO_3\left(thực.tế\right)}=0,04:80\%=0,05mol\\ m_{KNO_3\left(cần\right)}=0,05.101=5,05g\\ \Rightarrow B\)

Hướng dẫn: câu a, lập phương trình tự làm nha
b, có 6,4 g O2 thì tính được mol O2, theo phương trình tính được mol KNO3 rồi tính được khối lượng KNO3. mKNO3(thực tế)=mKNO3(tính theo PTHH)x100/H
c, tương tự câu b nhưng mO2(thực tế)=mO2(lý thuyết)xH/100
a. PTHH: \(2KNO_3\rightarrow2KNO_2+O_2\)
b. \(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\)
Theo PT ta có: \(n_{KNO_3\left(theoPT\right)}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
\(n_{KNO_3\left(thực-tế\right)}=0,4:85\%=\dfrac{8}{17}\left(mol\right)\)
=> \(m_{KNO_3\left(thực-tế\right)}=\dfrac{8}{17}.101\approx47,53\left(g\right)\)
c. \(n_{KNO_3}=\dfrac{20,2}{101}=0,2\left(mol\right)\)
=> \(n_{KNO_3\left(pư\right)}=0,2.80\%=0,16\left(mol\right)\)
=> \(n_{O_2}=\dfrac{0,16.1}{2}=0,08\left(mol\right)\)
=> \(V_{O_2}=0,08.22,4=1,792\left(l\right)\)

a) PTHH: 2KNO3 -> (t°) 2KNO2 + O2
b) nKNO3 = 35,35/101 = 0,35 (mol)
nKNO2 = nKNO3 = 0,35 (mol)
mKNO2 = 0,35 . 85 = 29,75 (g)
c) nKNO3 = 40,4/101 = 0,4 (mol)
nO2(LT) = 0,4/2 = 0,2 (mol)
nO2(TT) = 0,2 . 75% = 0,15 (mol)
VO2 = 0,15 . 22,4 = 3,36 (l)

a) PTHH:
2KNO3→2KNO2 + O2
b)\(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)Theo PTHH ta có:
nKNO3=2nO2=0,15(mol)
mKNO3 ban đầu=0,15.101=15,15(g)
mKNO3 thực tế=15,15.\(\dfrac{85}{100}\)=12,8775(g)

Ta có PT: S + O2 ---> SO2. (1)
nS = 1,6/32=0,05(mol)
Theo PT(1), ta có:
nO2=nS=0,05(mol)
=> V=0,05.22,4=1,12(l)
2KNO3 ---> 2KNO2 + O2. (2)
Theo PT(2), ta có: nKNO3=2.nO2=2.0,05=0,1(mol)
=> m = 101.0,1=10,1(g)

Dùng KClO3
PTHH: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\uparrow\)
Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow n_{KClO_3}=\dfrac{2}{15}\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=\dfrac{2}{15}\cdot122,5\approx16,33\left(g\right)\)
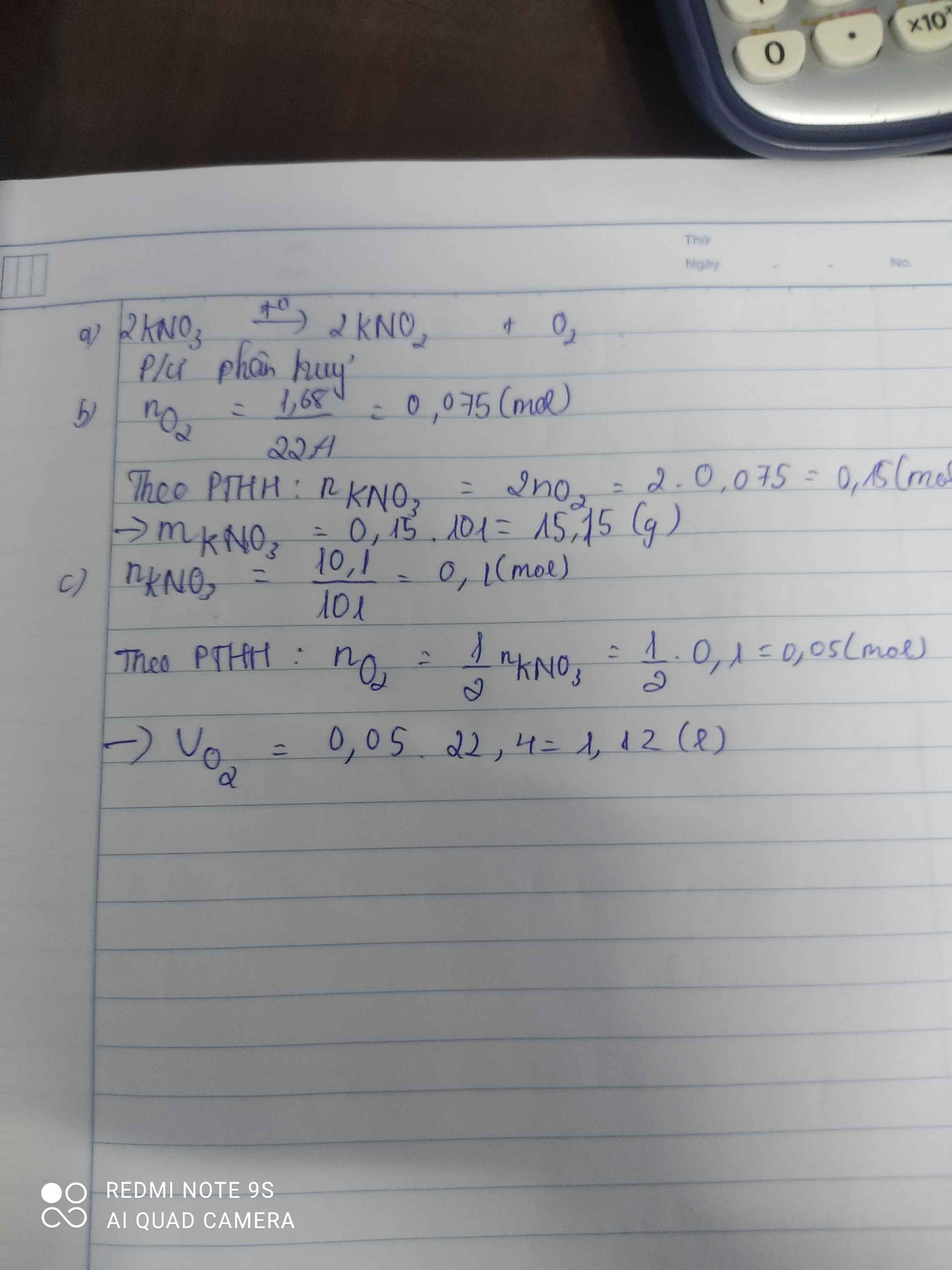
PTHH: 2KNO3 =(nhiệt)=> 2KNO2 + O2
Ta có: nO2 = \(\frac{6,4}{32}=0,2\left(mol\right)\)
=> nKNO3(theo phương trình) = 0,4 (mol)
=> nKNO3(thực tế) = \(0,4\div\frac{85}{100}=\frac{8}{17}\left(mol\right)\)
=> mKNO3(thực tế) = \(\frac{8}{17}\times101=47,53\left(gam\right)\)
Ta có:
\(PTHH:2KNO_3->>2KNO_2+O_2\)
Ta có:
\(n_{O_2}=\frac{m_{O_2}}{M_{O_2}}=\frac{6,4}{32}=0,2\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(n_{KNO_3}=2.n_{O_2}=2.0,2=0,4\left(mol\right)\)
Theo thực tế, ta được:
\(n_{KNO_3\left(thựctế\right)}=0,4:85\%=\frac{8}{17}\left(mol\right)\)
Khối lượng KNO3 trong thực tế:
\(m_{KNO_3\left(thựctế\right)}=n_{KNO_3}.M_{KNO_3}=\frac{8}{17}.101\approx47,529\left(g\right)\)