Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

kim loại a+oxi\(\overset{t^0}{\rightarrow}\)oxit a
kim loại b+khí oxi\(\overset{t^0}{\rightarrow}\)oxit b
-Áp dụng định luật Bảo toàn khối lượng:
mkim loại a,b+moxi=moxit a,b
\(\rightarrow\)moxi=moxit a,b-mkim loại a,b=6,05-4,45=1,6 gam

a) gọi M là hỗn hợp 5 kim loại Z ta có:
M + O2 ---> M2Ox
b) theo định luật bảo toàn khối lượng ta có:
mM + mo2 ---> mM2Ox
= 6.25+ mO2 -> 8.47
=> mO2 =8.47-6.25= 2.22 (gam)
vậy khỗi lượng O2 cần cho phản ứng trên là 2.22 gam

Các PTHH của phản ứng:
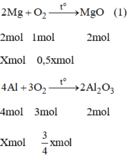
Khối lượng tăng bằng khối lượng của oxi tham gia phản ứng ⇒ m O 2 = 2g.
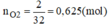
Vì Mg và Al có số mol bằng nhau. Gọi n M g = n A l = x mol
Từ phương trình (1) và (2) ta có:
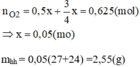

a) 2Mg+O2->2MgO
4Al+3O2->2Al2O3
Khối lượng oxi tham gia phản ứng:
14,2-7,8=6,4g
\(n_{O_2}=\frac{6,4}{32}=0,2\left(mol\right)\)
Đặt số mol Mg là x, số mol Al là y ta có hệ phương trình:
\(\left\{\begin{matrix}\frac{1}{2}x+\frac{3}{4}y=0,2\\24x+27y=7,8\end{matrix}\right.\)
giải hệ pt, ta được: x=0,1, y=0,2
\(m_{Mg}=0,1.24=2,4g\)
\(m_{Al}=0,2.27=5,4g\)
%Mg=\(\frac{2,4}{7,8}.100\%=30,76\%\)
%Al=100%-30,76%=69,24%
b) \(2KMnO_4\underrightarrow{t^o,..}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=2.n_{O_2}=2.0,2=0,4mol\)
\(m_{KMnO_4}=0,4.158=63,2g\)
P/S: Có cách giải khác không cần hệ, nếu bạn lớp 8 chưa biết giải mình post cho
Gợi ý:
a) - Đặt số mol Mg, Al lần lượt là a, b (mol)
- Tính khối lượng hỗn hợp ban đầu bà khối lượng oxit theo a, b
- Sau đó ta sẽ có hệ 2 phương trình
- Giải hệ 2 phương trình rồi tính % về khối lượng mỗi kim loại trong hỗn hợp đầu
- Kết luận...
b) - Theo phần a, ta biết được số mol mỗi chất => Ta sẽ tính được số mol O2 cần dùng theo phương trình hóa học.
- Từ số mol O2 đã suy ra được sẽ tính được số mol KMnO4 cần dùng
- Tính khối lượng KMnO4
- Kết luận...
Lưu ý: PTHH: 2KMnO4 =(nhiệt)=> K2MnO4 + MnO2 + O2
Bảo toàn khối lượng ta có: moxi=6,05-4,45=1,6g