Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M

Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=20\) (1)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{MgCl_2}+2n_{FeCl_2}=2n_{Mg}+2n_{Fe}=2a+2b\)
\(\Rightarrow2a+2b=0,5\cdot2\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,25\end{matrix}\right.\)
+) Trong không khí
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,125\left(mol\right)\\n_{MgO}=n_{Mg}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow m_1=0,125\cdot160+0,25\cdot40=30\left(g\right)\)
+) Trong chân không
Bảo toàn nguyên tố: \(n_{FeO}=n_{Fe}=n_{Mg}=n_{MgO}=0,25\left(mol\right)\)
\(\Rightarrow m_2=0,25\cdot72+0,25\cdot40=28\left(g\right)\)

Đáp án B
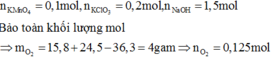
Khi cho hỗn hợp Y phản ứng với HCl đặc sẽ xảy ra phản ứng oxi hóa – khử tạo ra Cl2
![]()
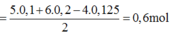


- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

Em có thể tham khảo cách giải sau:
Ta có: mO2 = (15,8 + 24,5)-36,3 = 4 gam. => nO2 = 0,125 mol.
nKMnO4 = 0,1 mol, nKClO3 = 0,2 mol.
Mn7+ + 5e -> Mn2+
Cl5+ + 6e -> Cl-1
2O2- -> O2 + 4e
2Cl-1 -> Cl2 + 2e
Bảo toàn electron, ta có: 0,1*5 + 0,2*6 = 0,125*4 + 2*nCl2
=> nCl2 =0,6 mol.
3Cl2 + 6NaOH -> 5NaCl + NaClO3 + 3H2O (vì đun nóng).
Bđ 0,6 1,5
P/ư 0,6 1,2 1,0 0,2
Sau p/ư 0 0,3 1,0 0,2.
=> m Rắn =0,3*40 + 1,0*58,5 + 0,2*106,5 = 91,8 gam.
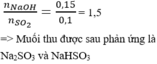
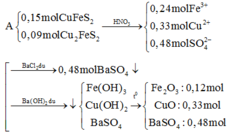
Fe + H2SO4 → FeSO4 + H2↑
ZnO + H2SO4 → ZnSO4 + H2O
MgSO3 + H2SO4 → MgSO4 + SO2↑ + H2O
Y: FeSO4, ZnSO4, MgSO4
Z: H2, SO2
SO2 + Ca(OH)2 → CaSO3↓ + H2O
G: CaSO3
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓
2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2↓
2NaOH + MgSO4 → Na2SO4 + Mg(OH)2↓
Q: Fe(OH)2, Zn(OH)2, Mg(OH)2
R: Na2SO4
4Fe(OH)2 + O2 \(\underrightarrow{to}\) 2Fe2O3 + 4H2O
Zn(OH)2 \(\underrightarrow{to}\) ZnO + H2O
Mg(OH)2 \(\underrightarrow{to}\) MgO + H2O
T: Fe2O3, ZnO, MgO