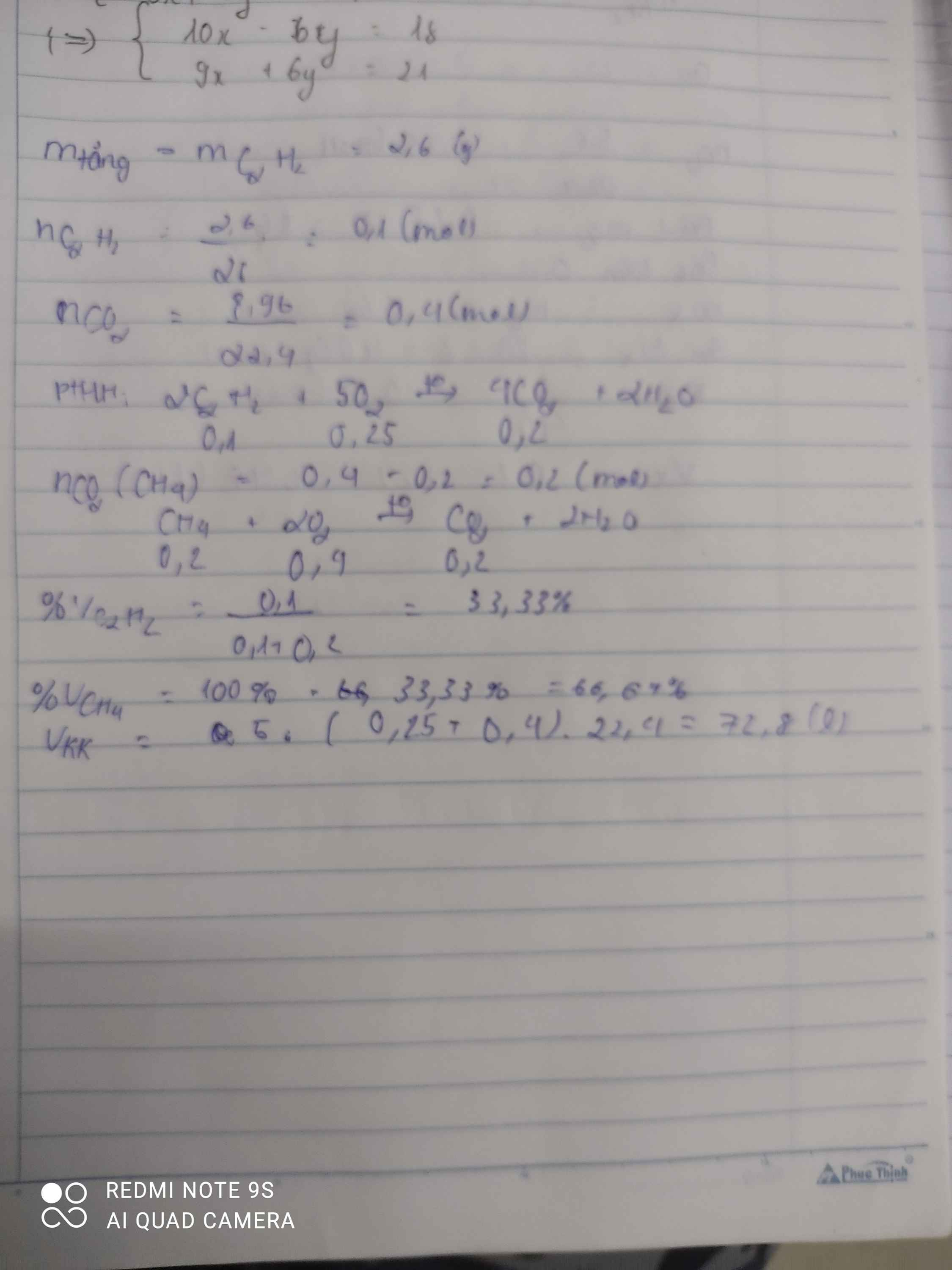Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chất A chứa C, H, O khi đốt cháy sẽ sinh ra CO 2 và H 2 O . Khi qua bình 1 đựng H 2 SO 4 đặc thì H 2 O bị hấp thụ. Vậy khối lượng H 2 O là 1,8 gam. Qua bình 2 có phản ứng :
Ca OH 2 + CO 2 → CaCO 3 ↓+ H 2 O
Theo phương trình : n CO 2 = n CaCO 3 = 10/100 = 0,1 mol
Vậy khối lượng cacbon có trong 3 gam A là 0,1 x 12 = 1,2 (gam).
Khối lượng hiđro có trong 3 gam A là 0,1 x 2 = 0,2 (gam).
Khối lượng oxi có trong 3 gam A là 3 - 1,2 - 0,2 = 1,6 (gam).
Gọi công thức phân tử của A là C x H y O z
Ta có :
60 gam A → 12x gam C → y g H → 16z gam O
3 gam → 1,2 gam → 0,2 gam → 1,6 gam
x = 1,2x60/36 = 2; y = 60x0,2/3 = 4
z = 1,6x60/48 = 2
→ Công thức phân tử của A là C 2 H 4 O 2

a, \(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\Rightarrow n_H=0,2.2=0,4\left(mol\right)\)
\(n_{CO_2}=n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)=n_C\)
⇒ mC + mH = 0,2.12 + 0,4.1 = 2,8 (g) < mA
→ A gồm C, H và O.
⇒ mO = 6 - 2,8 = 3,2 (g) \(\Rightarrow n_O=\dfrac{3,2}{16}=0,2\left(mol\right)\)
Gọi CTPT của A là CxHyOz.
⇒ x:y:z = 0,2:0,4:0,2 = 1:2:1
→ CTPT của A có dạng (CH2O)n
Không biết đề có cho thêm dữ kiện liên quan đến MA không bạn nhỉ?

Câu 1:
a,\(m_{Tang}=m_{etilen}=\frac{7}{28}=0,25\left(mol\right)\)
\(n_{hh}=\frac{8,96}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow\%V_{C2H4}=\frac{0,25}{0,4}.100\%=62,5\%\)
\(\Rightarrow\%V_{CH4}=100\%-62,5\%=37,5\%\)
b,\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
0,25_______0,25___________
\(\Rightarrow m_{Br2}=0,25.160=40\left(g\right)\)
c,\(n_{CH4}=0,4-0,25=0,15\left(mol\right)\)
\(CH_4+2O_2\underrightarrow{^{to}}CO_2+2H_2O\)
0,15____0,3____________
\(C_2H_4+3O_2\underrightarrow{^{to}}2CO_2+2H_2O\)
0,25_____0,75_________________
\(\Rightarrow V_{O2}=0,25.\left(0,3+0,75\right)=23,52\left(l\right)\)
Câu 2:
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(n_{C2H4}=0,2\left(mol\right)=n_{Br2}\)
\(\Rightarrow V_{Br2}=\frac{0,2}{0,5}=0,4\left(l\right)=400\left(ml\right)\)

a,
dẫn hỗn hợp trên qua bình đựng dung dịh nước brom thì C\(_2\)H\(_6\) không phản ứng chỉ có C\(_3\)H\(_4\) phản ứng
⇒ m\(_{C_3H_4}\)= m\(_{tăng}\) = 4 (gam)
⇒ n\(_{C_3H_4}\) = \(\dfrac{4}{40}\) = 0,1(mol)
C\(_3\)H\(_4\) + Br\(_2\) → C\(_3\)H\(_4\)Br\(_2\)
(mol) 0,1 → 0,1
⇒ m\(_{Br_2}\) (phản ứng) = 0,1 * 160 = 16(gam)
b,
\(\Rightarrow\) V\(_{C_3H_4}\) = 0,1 * 22,4 = 2,24 (lít)
⇒ %\(_{V_{C_3H_4}}\) = \(\dfrac{2,24}{7,2}\) * 100% \(\sim\) 31,1(%)
\(\Rightarrow\) %\(_{V_{C_2H_6}}\) = 100% - 31,1% ~ 68,9 (%)

\(n_{CO_2}=\dfrac{8,96}{22,4}=0,4mol\)
\(m_{tăng}=m_{Br_2}=m_{C_2H_2}=2,6g\)
\(\Rightarrow n_{C_2H_2}=\dfrac{2,6}{26}=0,1mol\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
0,1 0,1
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_2+\dfrac{5}{2}O_2\underrightarrow{t^o}2CO_2+H_2O\)
0,1 0,25 0,2
\(\Rightarrow n_{CO_2\left(CH_4\right)}=0,4-0,2=0,2mol\)
\(\Rightarrow n_{CH_4}=0,2mol\Rightarrow n_{O_2}=0,4mol\)
a)\(\%V_{CH_4}=\dfrac{0,2}{0,4}\cdot100\%=50\%\)
\(\%V_{C_2H_2}=100\%-50\%=50\%\)
b)\(\Sigma n_{O_2}=0,4+0,25=0,65mol\)
\(\Rightarrow V_{O_2}=0,65\cdot22,4=14,56l\)
\(\Rightarrow V_{kk}=14,56\cdot5=72,8l\)