Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,\(3Fe+2O_2\underrightarrow{^{to}}Fe_3O_4\)
\(n_{Fe}=\frac{16,8}{56}=0,3\left(mol\right)\)
\(\Rightarrow n_{O2}=0,2\left(mol\right);n_{Fe3O4}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe3O4}=0,1.232=23,2\left(g\right)\)
b,
\(V_{O2}=0,2.22,4=4,48\left(l\right)\)
\(\%O_2=\frac{1}{5}\Rightarrow V_{kk}=4,48.5=22,4\left(l\right)\)
c,
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO4}=0,4\left(mol\right)\)
\(\Rightarrow m_{KMnO4}=158.0,4=63,2\left(g\right)\)

Bài 1: Trong các oxit sau đây: SO3, CuO, Na2O, SO2, CO2, N2O3,CaO, Fe2O3, MgO, P2O5. Oxit naog là oxit axit, oxit bazơ? Gọi tên.
| oxit axi | gọi tên | oxit bazo | gọi tên |
| SO3 | Lưu huỳnh tri oxit | CuO | Đồng(II) oxit |
| SO2 | Lưu huỳnh đi oxit | Na2O | Natri oxit |
| CO2 | cacbon đi oxit | CaÒ | canxi oxit |
| N2O3 | đi Nito tri oxit | Fe2O3 | sắt(III) oxit |
| P2O5 | đi photpho pentaoxit | MgO | Magie oxit |
Bài 2:
S+O2--->SO2
2Cu+O2---->2CuO
4Na+O2--->2Na2O
2Ca+O2--->2CaO
3Fe+2O2---->Fe3O4
2Mg+O2--->2MgO
C+O2--->CO2
Bài 3
4P+5O2---->2P2O5
n P=6,2/31=0,2(mol)
n O2=6,72/22,4=0,3(mol)
0,2/4<0,3/5--->O2 dư.Tính theo chất hết
Theo pthh
n P2O5=1/2n P=0,1(mol)
m P2O5=0,1.142=14,2(g)
Bài 4
Fe2O3+3H2--->2Fe+3H2O
n Fe2O3=12/160=0,075(mol)
+n H2=3n Fe2O3=0,225(mol)
V H2=0,225.22,4=5,04(l)
+n Fe=2n Fe2O3=0,15(mol)
m Fe=0,15.56=8,4(g)
Bài 5.
a) Zn+H2SO4--->ZnSO4+H2
n Zn=19,5/65=0,3(mol)
Theo pthh
n ZnSO4=n Zn=0,3(mol)
m ZnSO4=0,3.161=48,3(g)
b) n H2=n Zn=0,3(mol)
V H2=0,3..22,4=6,72(l)
c)H2+CuO---->Cu+H2O
n CuO=16/80=0,2(mol)
--->H2 dư
n H2=n CuO=0,2(mol)
n H2 dư=0,3-0,2=0,1(mol)
m H2 dư=0,1.2=0,2(g)
Bài 6:
2KClO3---.2KCl+3O2
n O2=5,6/22,4=0,25(mol)
Theo pthh
n KClO3=2/3n O2=0,1667(mol)
m KClO3=0,1667/122,5=20,42(g)
Bị hao hụt 10%
--> m KClO3=20,42-(2042.10%)=18,378(g)
Bài 1 :
Oxit bazo: CuO,Na2O,CaO,Fe2O3,MgO
CuO: Đồng II oxit
Na2O: Natri oxit
CaO: Canxi oxit
Fe2O3: Sắt III oxit
MgO: Magie oxit
Oxit axit: SO3,SO2,CO2,N2O3,P2O5
SO3: Lưu huỳnh trioxit
SO2: Lưu huỳnh dioxit
CO2: Cacbon dioxit
N2O3: Đinito trioxit
P2O5: Điphotpho penta oxit
Bài 2 :
\(S+O_2\rightarrow SO_2\)
\(2Cu+O_2\rightarrow2CuO\)
\(4Na+O_2\rightarrow2Na_2O\)
\(2Ca+O_2\rightarrow2CaO\)
\(C+O_2\rightarrow CO_2\)
\(3Fe+2O_2\rightarrow Fe_3O_4\)
\(2Mg+O_2\rightarrow2MgO\)
Bài 3:
\(4P+5O_2\rightarrow2P_2O_5\)
Ta có: \(n_P=\frac{6,2}{31}=0,2\left(mol\right);n_{O2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
Vì \(n_{O2}>\frac{5}{4n_P}\) nên O2 dư
\(\rightarrow n_{P2O5}=\frac{1}{2}n_P=0,1\left(mol\right)\)
\(\rightarrow m_{P2O5}=0,1.\left(31.2+16.5\right)=14,2\left(g\right)\)
Bài 4:
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Ta có: \(n_{Fe2O3}=\frac{12}{56.2+16.3}=0,075\left(mol\right)\)
\(\rightarrow n_{H2}=3n_{Fe2O3}=0,225\left(mol\right)\)
\(\rightarrow V_{H2}=0,225.22,4=5,04\left(l\right)\)
\(n_{Fe}=2n_{Fe2O3}=0,15\left(mol\right)\rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
Bài 5:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Ta có: \(n_{Zn}=\frac{19,5}{65}=0,3\left(mol\right)\)
Theo phản ứng:
\(n_{Zn}=n_{ZnSO4}=n_{H2}=0,3\left(mol\right)\)
\(\rightarrow m_{H2SO4}=0,3.\left(65+96\right)=48,3\left(g\right)\)
\(\rightarrow V_{H2}=0,3.22,4=6,72\left(l\right)\)
\(H_2+CuO\rightarrow Cu+H_2O\)
Ta có:
\(n_{CuO}=\frac{16}{64+16}=0,2\left(mol\right)\)
Vì nH2 > nCuO nên H2 dư
\(\rightarrow n_{H2_{du}}=0,3-0,2=0,1\left(mol\right)\rightarrow m_{H2}=0,1.2=0,2\left(g\right)\)
Bài 6 :
Oxi hao hụt 10% \(\rightarrow H=90\%\)
\(n_{O2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(2KClO_3\rightarrow2KCl+3O_2\)
1/6_______________0,25
Mà H = 90%
\(\rightarrow m_{KClO3_{can}}=\frac{\frac{1}{6}.122,5}{90\%}=22,69\left(g\right)\)
Bài 7:
Khí là SO2; bột là P2O5
\(S+O_2\rightarrow SO_2\)
\(4P+5O_2\rightarrow2P_2O_5\)
Chất bột là P2O5
\(\rightarrow m_{P2O5}=28,4\left(g\right)\rightarrow n_{P2O5}=\frac{28,4}{31,2+16.5}=0,2\left(mol\right)\)
\(\rightarrow n_P=2n_{P2O5}=0,4\left(mol\right)\)
Vì \(n_{P2O5}=2n_{SO3}\rightarrow n_{SO2}=0,1\left(mol\right)\rightarrow n_S=0,1\left(mol\right)\)
\(\rightarrow m_P+m_S+0,4.31+0,1.32=15,6\left(g\right)\rightarrow m=\frac{15,6}{80\%}=19,5\left(g\right)\)
\(\rightarrow\%m_P=\frac{0,4.31}{19,5}=63,6\%;\%m_S=\frac{0,1.32}{19,5}=16,4\%\)
c) \(n_{O2_{pu}}=2n_{O2}+\frac{5}{4}n_P=0,1.2+\frac{5}{4}.0,4=0,7\left(mol\right)\)
Vậy số phân tử O2 \(=0,7.6.10^{23}=4,3.10^{23}\) (phân tử)
Bài 8:
\(3Fe+2O_2\rightarrow Fe_3O_4\)
Ta có: \(n_{Fe2O3}=\frac{2,32}{56.3+16.4}=0,01\left(mol\right)\)
\(\rightarrow n_{Fe}=3n_{Fe3O4}=0,03\left(mol\right)\rightarrow m_{Fe}=0,03.56=1,68\left(g\right)\)
\(\rightarrow n_{O2}=2n_{Fe3O4}=0,02\left(mol\right)\rightarrow m_{O2}=0,02.32=0,64\left(g\right)\)
\(2KMnO_4\rightarrow K_2MnO_4+MnO_4+O_2\)
\(\rightarrow n_{KMnO4}=2n_{O2}=0,04\left(mol\right)\rightarrow m_{KMnO4}=0,04.\left(39+55+16,4\right)=6,32\left(g\right)\)
Bài 9:
\(4Al+3O_2\rightarrow2Al_2O_3\)
Ta có: \(n_{Al}=\frac{5,4}{27}=0,2\left(mol\right)\)
\(\rightarrow n_{O2}=\frac{3}{4}n_{Al}=0,15\left(mol\right)\rightarrow V_{O2}=0,15.22,4=3,36\left(l\right)\)
\(2KMnO_4\rightarrow KMnO_4+MnO_2+O_2\)
\(\rightarrow n_{KMnO4}=2n_{O2}=0,3\left(mol\right)\)
\(\rightarrow m_{KMnO4}=0,3.\left(39+55+16.4\right)=47,4\left(g\right)\)
Bài 10:
\(m_C=1000.95\%=950\left(g\right)\)
\(C+O_2\rightarrow CO_2\)
12g_______ 44g
950g_______g
\(\Rightarrow x=\frac{950.44}{12}=3483\left(g\right)\)
=>V=3483/44x22,4=1773 l=1,773 m3

H2 + 1/2O2 = H20
nH2=4,48:22,4=0,2(mol)
Theo PTPU:nO2=1/2.nH2=1/2.0,2=0,1(mol)
=>VO2=0,1.22,4=2,24(l)
b)Theo PTPU:nH2O=nH2=0,2(mol)
=>mH2O=0,2.18=3,6(g)
c) H2 + FeO = Fe + H2O
Theo PTPU:nFe=nH2=0,2(mol)
=>mFe=0,2.56=11,2(g)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2H2 + O2 -to-> 2H2O (1)
Theo PTHH và đề bài, ta có:
\(n_{O_2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ n_{H_2O}=n_{H_2}=0,2\left(mol\right)\)
a) Thể tích khí O2 cần dùng (đktc):
\(V_{O_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\)
b) Khối lượng H2O thu được:
\(m_{H_2O}=0,2.18=3,6\left(g\right)\)
c) PTHH: H2 + FeO -to-> Fe + H2O (2)
Từ các PTHH và đb, ta có:
\(n_{H_2\left(2\right)}=n_{H_2\left(1\right)}=0,2\left(mol\right)\\ =>n_{Fe}=n_{H_2\left(2\right)}=0,2\left(mol\right)\)
Khối lượng Fe thu được:
\(m_{Fe}=0,2.56=11,2\left(g\right)\)

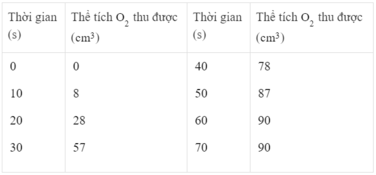
Thể tích khí oxi thu được ở các thời điểm :
25 giây : Khoảng 40 cm 3
45 giây : Khoảng 83 cm 3

Đáp án C
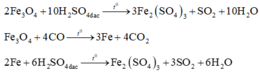
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.

Với lần thí nghiệm thứ nhất, có sự tham gia của O. Áp dụng định luật bảo toàn mol electron, ta có:
![]()
Với lần thí nghiệm thứ hai, không có sự tham gia của O. Áp dụng định luật bảo toàn mol
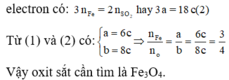

Đáp án C
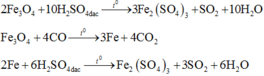
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.
Gọi thì ![]()
Các quá trình nhường và nhận electron diễn ra như sau:
Quá trình nhường electron:



Bài 1
a)\(2Zn+O2-->2ZnO\)
b)\(n_{ZnO}=\frac{48,6}{81}=0,6\left(mol\right)\)
\(n_{O2}=\frac{1}{2}n_{Zn}=0,3\left(mol\right)\)
\(V_{O2}=0,3.22,4=6,72\left(l\right)\)
c)Cách 1
\(n_{Zn}=n_{ZnO}=0,6\left(mol\right)\)
\(m_{Zn}=0,6.65=39\left(g\right)\)
Cách 2
\(m_{O2}=0,3.32=9,6\left(g\right)\)
\(m_{Zn}=m_{ZnO}-m_{O2}=48,6-9,6=39\left(g\right)\)
Bài 2
a)\(m_{Mg}=9,6.12,5\%=1,2\left(g\right)\)
\(m_{Fe}=9,6-1,2=8,4\left(g\right)\)
b)\(2Mg+O2-->2MgO\)
\(3Fe+2O2-->Fe3O4\)
\(n_{Mg}=\frac{1,2}{24}=0,05\left(mol\right)\)
\(n_{Fe}=\frac{8,4}{56}=0,15\left(mol\right)\)
\(n_{MgO}=n_{Mg}=0,05\left(mol\right)\)
\(m_{gO}=0,05.40=2\left(g\right)\)
\(n_{Fe3O4}=\frac{1}{3}n_{Fe}=0,05\left(mol\right)\)
\(m_{Fe3O4}=0,05.232=11,6\left(g\right)\)

Chỉ có HCl tác dụng với MnO2 ở nhiệt độ thường mới điều chế được khí Clo.
Các cặp chất khác đều có nhiệt độ cao.

Trong phòng TN, người ta thường cho HCl đặc tác dụng với các chất oxi hóa mạnh như MnO2; KMnO4; KClO3; K2Cr2O7.
\(n_{Fe_3O_4}=\frac{3,48}{232}=0,015mol\)
\(PTHH:3Fe+2O_2\rightarrow^{t^o}Fe_3O_4\)
\(m_{Fe}=0,045.56=2,52g\)
\(V_{O_2}=0,03.22,4=0,672l\)