Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, (1) 4P+5.O2->2.P2O5
(2) P2O5+4.NaOH->2.Na2HPO4+H2O
b, photpho có n=6,2:31=0,2 mol.dựa theo pt (1) thấy nP2O5=0,1mol.theo pt (2) thấy nNaOH=0,4mol vậy mNaOH=0,4.40=16 g vậy m(dd NaOH)=16:32%=50 g
c, theo pt (2) nNa2HPO4 =0,2 mol vậy mNa2HPO4=0,2.142=28,4 g
m(dd sau pư)=mP+m(dd NaOH)=6,2+50=56,2 g
=> C%(dd Na2HPO4)=28,4:56,2=50,53%

(1) sai, khoáng vật chính của photpho trong tự nhiên là apatit và photphorit
(2) đúng
(3) đúng
(4) sai, trong phòng thí nghiệm, axit photphoric được điều chế bằng phản ứng giữa P và
H
N
O
3
đặc
(5)sai, P hoạt động hơn N do N tồn tại ở
N
2
có liên kết ba bền
Đáp án B

Đáp án C
P thể hiện tính oxi hóa khi tác dụng với chất khử, số oxi hóa giảm sau phản ứng
![]()

Halogenua của photpho có thể có công thức PX3 hoặc PX5.
*Xét trường hợp PX3:
PTHH PX3 + 3H2O \(\rightarrow\) H3PO3 + 3HX
H3PO3 + 2NaOH \(\rightarrow\) Na2HPO3 + 2H2O ( axit H3PO3 là axit hai lần axit)
HX + NaOH \(\rightarrow\) NaX + H2O
số mol NaOH = 2. 0,045 = 0,09 mol
Để trung hòa hoàn toàn sản phẩm thủy phân 1 mol PX3 cần 5 mol NaOH;
số mol PX3 = 1/5 số mol NaOH = 0,09/5 = 0,018 mol
Khối lượng mol phân tử PX3 = 2,475/0,018 = 137,5
Khối lượng mol cuả X = (137,5 – 31): 3 = 35,5 Þ X là Cl . Công thức PCl3
*Xét trường hợp PX5:
PX5 + 4H2O \(\rightarrow\) H3PO4 + 5HX
H3PO4 + 3NaOH \(\rightarrow\) Na3PO4 + 3H2O
HX + NaOH \(\rightarrow\) NaX + H2O
số mol NaOH = 2. 0,045 = 0,09 mol
Để trung hòa hoàn toàn sản phẩm thủy phân 1 mol PX5 cần 8 mol NaOH;
số mol PX5 = 1/8 số mol NaOH = 0,09/8 = 0,01125 mol
Khối lượng mol phân tử PX5 = 2,475/0,01125 = 220
Khối lượng mol cuả X = (220 – 31): 5 = 37,8 \(\Rightarrow\) không ứng với halogen nào.
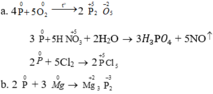
a) Tăng
\(4P+5O_2\) \(\underrightarrow{to}\) \(2P_2O_5\)(tăng từ 0 lên +5)
b) Giảm:
\(2P+3Ca\) \(\underrightarrow{to}\) \(Ca_3P_2\) (giảm từ 0 xuống -3)