Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)NaOH+SO2 \(\rightarrow\) NaHSO3 (1)
NaOH+SO2 \(\rightarrow\) Na2SO3+H2O (2)
b)Ta có co số mol SO2 là : n = 12,8 / 64 = 0,2
số mol NAOH là : n =0,25 x 1 = 0,25
Ta có tỷ lệ :
n [NaOH]/ n [SO2] = 0,25/0,2 = 1,25
Nên sẽ xảy ra đồng thời 2 phản ứng 1 và 2
NaOH + SO2 = NaHSO3 (1)
x mol x mol x mol
2NaOH + SO2 = Na2So3 + H2O (2)
y mol y/2 mol y/2 mol
Từ (1)(2): Ta có hệ phương trình :
x+y = 0,25
x+y/2 = 0,2
Giải hệ trên ta có x = 0,15 mol
y= 0,1 mol
Khối lượng muối sau phản ứng sẽ bao gồm 2 muối là NaHSO3 và NA2SO3
Số mol Nahso3 = x = 0,15 mol
==> Khối lương NAHSO3 = 0,15 x 104 = 15,6 g
Số mol NA2SO3 = y/2 = 0,1 /2 = 0,05 mol
==> Khối lượng NA2SO3 = 0,05 x 126 = 6,3 g
Vậy khối lượng muối thu dc sau phản ứng là : 15,6 + 6,3 = 21,9 g

Phương trình hóa học 4FeS2 + 11O2 => 2Fe2O3 + 8SO2
nFeS2 = 18/120 = 0,15 mol => nSO2 = 0,3 mol
nBa(OH)2 = 0,25 mol. Như vậy trường hợp này tạo hai muối.
Gọi x, y lần lượt là số mol muối trung hòa và axit.
Có hệ phương trình về số mol của Ba(OH)2 và SO2 là:
x + y = 0,25 và x + 2y = 0,3
Giải hệ PT được: x = 0,2 và y = 0,05
=> Khối lượng muối là m = 0,2.197 + 0,05.259 = 52,35 gam
- Bảo toàn S => nSO2 = 2nFeS2 = 0.3
- tỉ lệ nSO2 / nBa(OH)2 = 1.2 => tạo thành BaSO3 (x mol) và Ba(HSO3)2 (y mol)
+ Bảo toàn S => x+2y=0.3 (1)
Bảo toàn Ba => x+y=0.25 (2)
+ (1) +(2) => x= 0.2 , y= 0.05
=> BaSO3=43.4 g ;Ba(HSO3)2=14.95 g

nSO2 = 12,8 / 64 = 0,2 mol.
nNaOH = 1 x250 / 1000 = 0,25 mol.
a) Phương trình hóa học của phản ứng
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Gọi nNa2SO3 = x; nNaHSO3 = y.
nNaOH = 2y + x = 0,25.
nSO2 = x + y = 0,2.
Giải ra ta có: x = 0,15, y = 0,05.
mNaHSO3 = 0,15 x 104 = 15,6g.
mNa2SO3 = 0,5 x 126 = 63g.

Gọi số mol của NO2 và NO là a và b
Ta có hệ phương trình :
\(\left\{{}\begin{matrix}a+b=\frac{1,12}{22,4}\\\frac{46a+30b}{a+b}=16,75.2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,01\\b=0,04\end{matrix}\right.\)
\(n_{HNO3}=n_{HNO3_{tao.muoi}}+n_{N\left(pu.khử\right)}=2n_{NO2}+4n_{NO}\)
\(=0,18\left(mol\right)\)
\(\Rightarrow CM_{HNO3}=0,65M\)
\(m_{muoi}=m_{pu}+m_{NO3}=\left(6,25-2,516\right)+\left(0,01.1+0,04.3\right).62\)
\(=11,794\left(g\right)\)


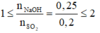 ⇒ phản ứng tạo 2 muối
⇒ phản ứng tạo 2 muối
Phương trình hóa học của phản ứng
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Gọi nNa2SO3 = x mol; nNaHSO3 = y mol
nNaOH = 2x + y = 0,25.
nSO2 = x + y = 0,2.
Giải ra ta có: x = 0,05, y = 0,15.
mNaHSO3 = 0,15 x 104 = 15,6g.
mNa2SO3 = 0,05 x 126 = 6,3g.

Câu 2.Hấp thụ hoàn toàn 12,8 gam SO2 vào 250 ml dung dịch NaOH 1M.
a) Viết các phương trình hóa học của phản ứng xảy ra. b) Tính khối lượng muối tạo thành sau phản ứng.
----
a) nSO2= 12,8/64= 0,2(mol)
nNaOH= 0,25.1=0,25(mol)
Ta có tỉ lệ: 1< nNaOH/nSO2= 0,25/0,2=1,25 <2
=> Tạo 2 muối: Na2CO3 và NaHCO3
Gọi x, y lần lượt là số mol NaOH (1) và NaOH (2)
PTHH: 2 NaOH + CO2 -> Na2CO3 + H2O (1)
x______________0,5x___0,5x(mol)
NaOH+CO2 -> NaHCO3 (2)
y______y_____y(mol)
=> \(\left\{{}\begin{matrix}x+y=0,25\\0,5x+y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,15\end{matrix}\right.\)
b) =>mNa2CO3=0,5.106x=0,5.106.0,1= 5,3(g)
mNaHCO3=0,15.84= 12,3(g)
-> m(muối)= mNa2CO3+ mNaHCO3= 5,3+12,3= 17,6(g)
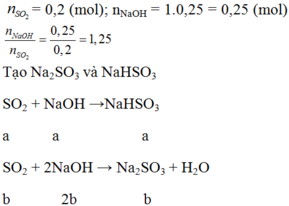
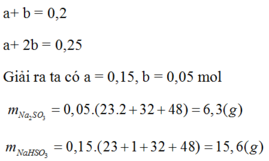

nSO2 = 12,8 /64 = 0,2 (mol)
n NaOH = (250/1000) . 1 = 0,25 (mol)
=> nOH - / n SO2 = 0,25 /0,2 = 1,25
=> tạo 2 muối
Gọi nSO2 ở lần lượt hai phương trình là x(mol) và y (mol)
SO2 + 2NaOH ---------->Na2SO3 + H2O
x --------2x------------------x
SO2 + NaOH------------> NaHSO3
y--------y-------------------y
Ta có hệ :\(\left\{{}\begin{matrix}x+y=0,2\\2x+y=0,25\end{matrix}\right.\)
Giải hệ ta được : x = 0,05 (mol) ; y = 0,15 (mol)
=> m Na2CO3 = 0,05 .106 =5,3 (g)
m NaHCO3 = 84.0,15=12,6 (g)