Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTPƯ:
\(CaCO_3\underrightarrow{t^o}CaO+CO_2\)\(\uparrow\)
0,015 0,015 0,015
\(nCaCO_3=\dfrac{1,5}{100}=0,015mol\)
\(mCaO=0,015.56=0,84\)(tấn)

Ta có phương trình hóa học :
\(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
Theo phương trình :
Cứ \(1\) mol \(CaCO_3\) nhiệt phân tạo 1 mol CaO
Hay 100g CaCO3 nhiệt phân tạo 56g CaO
Hay 100 tấn CaCO3 nhiệt phân tạo 56 tấn CaO
Vậy khối lượng CaCO3 tạo ra 1,4 tấn CaO là :
\(m_{CaCO3.pư}=\dfrac{1,4.100}{56}=2,5\)(tấn)
Do hiệu suất 80% nên khối lượng CaCO3 ban đầu là :
\(m_{CaCO3.bđ}=\dfrac{2,5}{80\%}=3,125\) ( tấn )
Khối lượng đá vôi đem đi nung là :
\(m=\dfrac{3,125}{75\%}=4,167\)( tấn )
CaCO3 -to->CaO + CO2
100 56
2,5 ← 1,4
mCaCO3 (lý thuyết) = \(\dfrac{2,5.100}{80}\)= 3,125 gam (tấn) (đề bài không rõ đơn vị)
Khối lượng đá vôi = \(\dfrac{3,125.100}{75}\)= 4,17 gam (tấn)

a) \(300kg=300000g\)
\(CaCO3-->CaO+CO2\)
\(n_{CaCO3}=\frac{300000}{100}=3000\left(mol\right)\)
\(n_{CaO}=n_{CaCO3}=3000\left(mol\right)\)
\(m_{CaO}=3000.56=168000\left(g\right)=168\left(kg\right)\)
Mk nghĩ đề là 134,4 kg ý
\(H\%=\frac{134,4}{168}.100\%=80\%\)
b) \(CaCO3-->CaO+CO2\)
\(1tấn=1000000g\)
\(n_{CaCO3}=\frac{1000000}{100}=10000\left(mol\right)\)
\(n_{CaO}=n_{CaCO3}=10000\left(mol\right)\)
\(m_{CaO}=10000.56=560000\left(g\right)=0,56\left(tấn\right)\)
Do H%=90%
\(\Rightarrow m_{CaO}=0,56.90\%=0,504\left(tấn\right)\)
c) \(7,84tấn=7840000\left(kg\right)\)
\(n_{CaO}=\frac{78400000}{56}=1400000\left(mol\right)\)
\(CaCO3-->CaO+CO2\)
\(n_{CaCO3}=n_{CaO}=1400000\left(mol\right)\)
\(m_{CaCO3}=1400000.100=140000000\left(g\right)=14tấn\)
a) CaCo3 \(\underrightarrow{t^o}\) CaO + Co2
3 -> 3 -> 3 /mol
nCaCo3 = \(\frac{300}{100}=3\left(mol\right)\)
\(m_{CaOpt}\) = 3.56 = 168 (g)
H = \(\frac{134,4}{168}.100\%=80\%\)
b) Giả sử nung 1 tấn CaCo3 là nung 1g CaCo3
CaCo3 \(\underrightarrow{t^o}\) CaO + Co2
0,01 -> 0,01 -> 0,01 /mol
nCaCo3 = \(\frac{1}{100}=0,01\left(mol\right)\)
mCaOpt = 0,01.56 = 0,56 (g)
mCaOtt = 0,56.90% = 0,504 (g)
Vậy thu được 0,504 tấn CaO khi nung 1 tấn CaCo3 với hiệu suất 90%
c) Giả sử 7,84 tấn CaO là 7,84 g CaO
CaCo3 \(\underrightarrow{t^o}\) CaO + Co2
0,098 <- 0,098 /mol
mCaOpt = 7,84.70% = 5,488 (g)
nCaO = \(\frac{5,488}{56}=0,098\left(mol\right)\)
mCaCo3 = 0,098.100 = 9,8 (g)
Vậy cần dùng 9,8 tấn CaCo3 để sau phản ứng thu đc 7,84 tấn CaO với hiệu suất 70%

a) Công thức về khối lượng phản ứng:
mCaCO3 = mCaO + mCO2
b) mCaCO3 = 280 + 110 = 390 kg
=> %CaCO3
= \(\frac{390}{560}\) = 69,7%

1)
1,2 tấn = 1200(kg)
5 tạ = 500(kg)
mCaCO3=1200.80%=960(kg)mCaCO3=1200.80%=960(kg)
CaCO3to→CaO+CO2nCaCO3 pư=nCaO=50056(mol)⇒H=50056.100960.100%=93%
\(m_{\text{CaCO_3}}=1000.95\%=950kg\\ \rightarrow n_{\text{CaCO_3}}=9,5mol\)
\(m_{CaCO_3}\underrightarrow{t^o}CaO+CO_2\)
9,5 → 9,5
\(\rightarrow V_{CO_2}=9,5.22,4=212,8\)
→ hiệu suất phản ứng là
\(\dfrac{159,6}{212,8}.100=75\%\)

1)
1,2 tấn = 1200(kg)
5 tạ = 500(kg)
\(m_{CaCO_3} = 1200.80\% = 960(kg)\)
\(CaCO_3 \xrightarrow{t^o} CaO + CO_2\\ n_{CaCO_3\ pư} = n_{CaO} = \dfrac{500}{56}(mol)\\ \Rightarrow H = \dfrac{\dfrac{500}{56}.100}{960}.100\% = 93\%\)
1 (H)= 93,11%
2 (H)=88.08%
m cao=1.064(tấn)
==> m cr = 1.065(tấn)
%m cao = 56%

a) mCaCO3 = mCaO + mCO2
b) Khối lượng của CaCO3 đã phản ứng:
140 + 110 = 250 kg
Tỉ lệ phần trăm khối lượng CaCO3 chứa trong đá vôi:
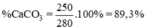
1 tấn = 1000 kg
a, Ta có: \(n_{CaCO_3}=\dfrac{1000}{100}=10\left(kmol\right)\)
PT: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
______10______10_____10 (kmol)
⇒ mCaO = 10.56 = 560 (kg)
mCO2 = 10.44 = 440 (kg)
b, 504 (g) = 0,504 (kg)
\(\Rightarrow H\%=\dfrac{0,504}{560}.100\%=0,09\%\)